题目内容
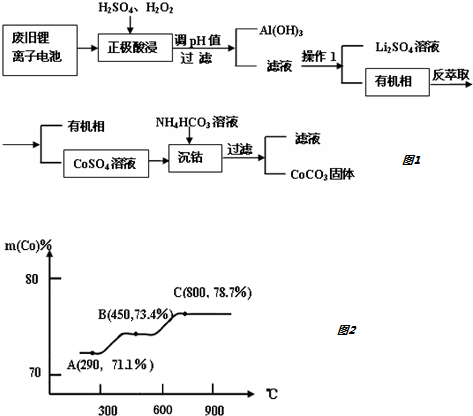
2.某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴.
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离.
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、2H++2e-═H2↑.
阳极的电极反应式为4OH--4e-═O2↑+2H2O.
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示.当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降.
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部.用以下步骤继续回收钴如图3.
①写出“酸浸”过程中正极粉发生反应的化学方程式:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O.该步骤一般在80℃以下进行,温度不能太高的原因是防止H2O2剧烈分解.
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是AC(填字母序号).
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(C2O42-)+c(OH-)+c(HC2O4-)
C.c(NH4+)+c(NH3•H2O)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2 的质量分数为a%,则回收后得到CoC2O4•2H2O 的质量不高于$\frac{1.83ax}{98}$g.
分析 (1)①H+也会在阴极放电生成氢气,阴离子氢氧根离子在阳极放电;
②如图2所示.当c(H2SO4)>0.4mol•L-1时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(2)①“酸浸”过程中正极粉发生氧化还原反应,LiCoO2氧化生成Co2+和O2,方程式为2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O;该步骤一般在80℃以下进行,温度太高,双氧水会受热分解;
②(NH4)2C2O4溶液呈弱酸性,故
A.根据离子浓度大小分析,(NH4)2C2O4溶液呈弱酸性;
B.由电荷守恒分析,溶液中阴阳离子所带电荷总数相同;
C.由物料守恒分析,n(N)=n(C2O42-);
(3)根据关系式:LiCoO2~CoC2O4•2H2O,列式计算即可.
解答 解:(1)①H+也会在阴极放电,2H++2e-═H2↑;阴离子在阳极放电,4OH--4e-═O2↑+2H2O,
故答案为:2H++2e-═H2↑;4OH--4e-═O2↑+2H2O;
②如图2所示.当c(H2SO4)>0.4mol•L-1时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降,
故答案为:H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(2)①“酸浸”过程中正极粉发生氧化还原反应,LiCoO2氧化生成Co2+和O2,方程式为2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O;该步骤一般在80℃以下进行,温度太高,双氧水会受热分解;
故答案为:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O;防止H2O2剧烈分解;
②(NH4)2C2O4溶液呈弱酸性,故
A.由离子浓度大小关系,知c (NH4+)>c(C2O42-)>c (H+)>c (OH-),故A正确;
B.由电荷守恒,可知c (H+)+c (NH4+)=c (OH-)+c(HC2O4-)+2c(C2O42-),故B错误;
C.由物料守恒,可知c (NH4+)+c (NH3•H2O)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)],故C正确;
故答案为:AC;
(3)根据关系式:LiCoO2~CoC2O4•2H2O
98 183
xa%g m
解之得m=$\frac{1.83ax}{98}$,
故答案为:$\frac{1.83ax}{98}$.
点评 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等,难点是电极反应式的书写.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 原子序数为7 | B. | 周期表中第一电离能最小 | ||
| C. | 周期表中原子半径最大 | D. | 周期表中电负性最大 |
| A. | 苯不能使酸性KMnO4溶液褪色 | |
| B. | 苯不能使溴水因发生化学反应而褪色 | |
| C. | 苯在加热和有催化剂存在条件下与H2反应生成环己烷 | |
| D. | 邻二氯苯只有一种结构 |
| A. | SO2 | B. | NH3 | C. | NO | D. | NO2 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar(用元素符号作答).
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式)HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中(除稀有气体),原子半径最小的是(填元素符号)F,原子半径最大的是K.
(5)在⑤与④中,化学性质较活泼的是(填元素名称)镁,设计一个简单实验(只要写出实验方案即可),用化学实验证明.分别与水反应根据反应剧烈程度进行判断.
(6)在⑧与 ⑦中,单质的化学性质较活泼的是氯气,写出可以验证该结论的化学方程式Cl2+2H2S=2HCl+S↓.
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题: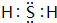 .
.
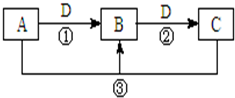 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空: