题目内容
2.某课外活动小组利用高锰酸钾和浓盐酸来制取氯气,反应的化学方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
(1)浓盐酸在此反应中显示出来的性质是酸性和还原性.
(2)若有15.9g的高锰酸钾与足量的浓盐酸反应,则被氧化的氯化氢的物质的量为0.5mol.
分析 (1)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,盐酸中的氯的化合价部分变,部分升高,所以盐酸具有酸性和还原性;
(2)根据氧化还原反应和制取氯气的化学方程式分析.
解答 解:(1)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,盐酸中的氯的化合价部分变,部分升高,所以盐酸具有酸性和还原性,故答案为:酸性和还原性;
(2)15.9gKMnO4的物质的量为$\frac{15.9g}{158g/mol}$=0.1mol,则:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.1mol n(HCl) n(Cl2)
所以,n(Cl2)=$\frac{0.1mol×5}{2}$=0.25mol,被氧化的HCl生成氯气,故被氧化的HCl的物质的量为0.25mol×2=0.5mol,
故答案为:0.5mol.
点评 本题考查了实验室制取氯气的反应原理和根据化学方程式的计算,以及与制取氯气有关的氧化还原反应知识,较为综合,也较为基础,能很好地考查知识和能力.

练习册系列答案
相关题目
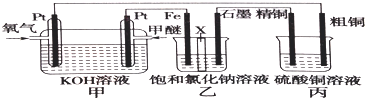
1.下列关于原电池的说法错误的是( )


| A. | ①、②装置都能将化学能转化为电能 | |
| B. | ②中的硫酸根离子向负极移动 | |
| C. | ②中的电子轴Zn经过导线流向Cu | |
| D. | ②中铜片上发生的电极反应式为2H++2e-=2H2↑ |
2.1-乙炔基-1-环己醇可用作加成型硅橡胶储存稳定剂、硅氢加成反应抑制剂,还可用作油墨、油漆以及涂料的催干剂等,其结构如图所示: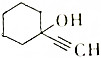 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮( 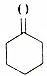 ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(  ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )| A. | 1:1 | B. | 1:2 | C. | 13:49 | D. | 24:49 |
10.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2•6H2O晶体,其工艺流程为:
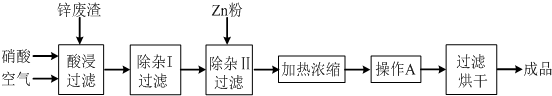
有关氢氧化物开始沉淀和沉淀完全的pH如表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等).(至少写出一个措施)
(2)上述工艺流程中多处涉及“过滤”,过滤时洗涤沉淀的操作是沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.调节pH所用X可以选用AB.
A.ZnO B.ZnCO3 C.H2SO4 D.HNO3
检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却结晶.

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,过滤时洗涤沉淀的操作是沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.调节pH所用X可以选用AB.
A.ZnO B.ZnCO3 C.H2SO4 D.HNO3
检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却结晶.
7.NA为阿伏加德罗常数,下列物质所含分子数最少的是( )
| A. | 2 mol N2 | B. | 含NA个分子的Cl2 | ||
| C. | 标准状况下11.2 L的CH4 | D. | 6 g H2 (H2摩尔质量为2 g•mol-1) |
14.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法A.将气体通入盛有NaOH溶液的洗气瓶B.取样,滴加KSCN溶液C.取样,滴加酚酞试液D.取样,灼烧.
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
11.下列关于烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键;
②烷烃中除甲烷外,很多都能使高锰酸钾溶液的紫色褪去;
③分子通式为CnH2n+2的烃不一定是烷烃;
④所有的烷烃在光照条件下都能与氯气发生取代反应;
⑤光照条件下,乙烷通入氯水中,可使氯水褪色.
①在烷烃分子中,所有的化学键都是单键;
②烷烃中除甲烷外,很多都能使高锰酸钾溶液的紫色褪去;
③分子通式为CnH2n+2的烃不一定是烷烃;
④所有的烷烃在光照条件下都能与氯气发生取代反应;
⑤光照条件下,乙烷通入氯水中,可使氯水褪色.
| A. | ①③⑤ | B. | ②③ | C. | ①④ | D. | ①②④ |
12.一个外围电子构型为2s22p5的元素,下列有关它的描述正确的有( )
| A. | 原子序数为7 | B. | 周期表中第一电离能最小 | ||
| C. | 周期表中原子半径最大 | D. | 周期表中电负性最大 |
 .
.