题目内容
水的电离过程为H2O?H++OH-,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,则下列说法中正确的是( )
| A、水的电离过程是吸热过程 |
| B、c(H+)随着温度的降低而升高 |
| C、在35℃时,纯水中c(H+)>c(OH-) |
| D、水的电离度α(25℃)>α(35℃) |
考点:离子积常数
专题:
分析:水中存在电离平衡,电离过程是吸热过程,温度升高促进电离,氢离子浓度和氢氧根离子浓度增大;水中氢离子浓度始终等于氢氧根离子浓度,水是中性.
解答:
解:A、分析不同温度下其平衡常数,K(25℃)=1.0×l0-14,K(35℃)=2.1×l0-14,温度升高平衡常数增大,则水的电离是吸热过程,故A正确;
B、温度升高促进水的电离,氢离子浓度增大,故B错误;
C、在35℃时水电离出的氢离子浓度和氢氧根离子浓度比25°C大,但氢离子浓度和氢氧根离子浓度是相同的,水仍是中性,故C错误;
D、升温促进水的电离程度,水的电离度α(25℃)<α(35℃),故D错误;
故选A.
B、温度升高促进水的电离,氢离子浓度增大,故B错误;
C、在35℃时水电离出的氢离子浓度和氢氧根离子浓度比25°C大,但氢离子浓度和氢氧根离子浓度是相同的,水仍是中性,故C错误;
D、升温促进水的电离程度,水的电离度α(25℃)<α(35℃),故D错误;
故选A.
点评:本题考查了弱电解质的电离平衡分析判断,主要考查水的电离平衡的影响因素分析,题目较简单.

练习册系列答案
相关题目
Na、Mg、Al各2mol,分别与含1mol HCl的盐酸反应,在相同状况下产生的H2的体积之比为( )
| A、1:1:1 |
| B、1:2:3 |
| C、2:1:1 |
| D、3:2:1 |
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v (Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:分析实验数据所得出的结论不正确的是( )
| HCl |
| 实验 序号 | 初始浓度 c/mol?L-1 | 溴颜色消失 所需时间 t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.8 | 0.2 | 0.001 | 290 |
| ② | 1.6 | 0.2 | 0.001 | 145 |
| ③ | 0.8 | 0.4 | 0.001 | 145 |
| ④ | 0.8 | 0.2 | 0.001 | 580 |
| A、v (Br2)与c(CH3COCH3)成正比 |
| B、增大c(Br2),v (Br2)变小 |
| C、增大c(HCl),v (Br2)增大 |
| D、实验②和③的v (Br2)相等 |
下列溶液,一定呈中性的是( )
| A、由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液 |
| B、c(H+)=1.0×10-7mol?L-1的溶液 |
| C、pH=14-pOH的溶液 |
| D、pH=pOH的溶液 |
下列化学用语正确的是( )
| A、氟化氢的电子式:H:F |
| B、乙醇的分子式:CH3CH2OH |
C、硫原子的结构示意图: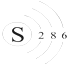 |
| D、Na2O2中即含有离子键,又含有非极性共价键 |
想一想:NaOH、CuSO4、CH3COOH这些物质为什么可以归为一类,下列哪些物质还可以和它们归为一类( )
| A、CO2 |
| B、HCl(气态) |
| C、Fe(OH)3胶体 |
| D、NaOH溶液 |