题目内容
下列化学用语正确的是( )
| A、氟化氢的电子式:H:F |
| B、乙醇的分子式:CH3CH2OH |
C、硫原子的结构示意图: |
| D、Na2O2中即含有离子键,又含有非极性共价键 |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.HF为共价化合物,存在共用电子对,氟原子最外层达到8电子稳定结构;
B.根据分子式与结构简式的概念及表示方法判断;
C.硫原子的核电荷数=核外电子总数为=16,最外层为6个电子;
D.过氧化钠中存在钠离子与过氧根离子之间形成的离子积,过氧根离子中还存在非极性共价键.
B.根据分子式与结构简式的概念及表示方法判断;
C.硫原子的核电荷数=核外电子总数为=16,最外层为6个电子;
D.过氧化钠中存在钠离子与过氧根离子之间形成的离子积,过氧根离子中还存在非极性共价键.
解答:
解:A.共价化合物电子式的书写是用.或x标出每个原子的最外层电子数以及原子间的共用电子对,使每个原子达到稳定结构,离子化合物电子式的书写是阴离子和复杂阳离子用[]括起来,在右上角标出电荷和电性,HF是共价化合物,不能写成离子化合物的形式;氟化氢为共价化合物,分子中存在1个F-H共价键,氟化氢正确的电子式为: ,故A错误;
,故A错误;
B.CH3CH2OH为乙醇的结构简式,分子式中不需要表示出官能团,乙醇正确的分子式为:C2H6O,故B错误;
C.硫原子的核电荷数、核外电子数相等,硫原子的结构示意图为: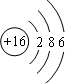 ,故C正确;
,故C正确;
D.过氧化钠的电子式为: ,其化学式中存在钠离子与过氧根离子形成的离子键,过氧根离子中存在非极性共价键,故D正确;
,其化学式中存在钠离子与过氧根离子形成的离子键,过氧根离子中存在非极性共价键,故D正确;
故选CD.
 ,故A错误;
,故A错误; B.CH3CH2OH为乙醇的结构简式,分子式中不需要表示出官能团,乙醇正确的分子式为:C2H6O,故B错误;
C.硫原子的核电荷数、核外电子数相等,硫原子的结构示意图为:
 ,故C正确;
,故C正确;D.过氧化钠的电子式为:
 ,其化学式中存在钠离子与过氧根离子形成的离子键,过氧根离子中存在非极性共价键,故D正确;
,其化学式中存在钠离子与过氧根离子形成的离子键,过氧根离子中存在非极性共价键,故D正确;故选CD.
点评:本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、原子结构示意图、分子式与结构简式等化学用语的书写原则,明确离子化合物与共价化合物的电子式、离子结构示意图与原子结构示意图的区别为解答关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各化合物的命名正确的是( )
| A、CH2=CH-CH=CH2 1,3-二丁烯 |
B、 2-甲基丁烷 2-甲基丁烷 |
C、 苯酚 苯酚 |
D、 间二甲苯 间二甲苯 |
下列有关阿伏加德罗常数(NA)的说法正确的是( )
| A、32 g O2所含的原子数目为NA |
| B、1 mol氢约含有6.02×1023个微粒 |
| C、标准状况下,2NA 个H2O的体积约为44.8 L |
| D、标准状况下,22.4 L CH4和H2的混合气体中含有NA个分子 |
水的电离过程为H2O?H++OH-,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,则下列说法中正确的是( )
| A、水的电离过程是吸热过程 |
| B、c(H+)随着温度的降低而升高 |
| C、在35℃时,纯水中c(H+)>c(OH-) |
| D、水的电离度α(25℃)>α(35℃) |
下列变化过程中,共价键被破坏的是( )
| A、烧碱固体融化 |
| B、氯化氢气体溶于水 |
| C、干冰气化 |
| D、碘溶于酒精 |
同温同压下,下列有关等体积的二氧化碳和氢气的比较中,正确的是( )
| A、物质的量比为1:1 |
| B、密度比为11:1 |
| C、质量比为1:22 |
| D、质子数比为3:2 |