题目内容
9.某海域海水一些化学成分如表所示,已知:25℃时,Ksp(CaCO3)=2.8×10-9,Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11.
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |

[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是HCO3-+H2O?H2CO3+OH-(写离子方程式).
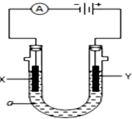
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.

(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
分析 海水中的成分为Na+、Ca2+、Mg2+、HCO3-、Zn2+,加氢氧化钠,与HCO3-反应生成CO32-再和Ca2+结合生成沉淀A碳酸钙,过滤,滤液中含有Na+、Mg2+、Zn2+,再加氢氧化钠溶液调节pH=11,Mg2+和Zn2+转化为沉淀B,则沉淀B为Mg(OH)2和Zn(OH)2,在沉淀B中加足量氢氧化钠,Zn(OH)2转化为[Zn(OH)4]2-,过滤,滤液为含有[Zn(OH)4]2-的溶液,滤渣为Mg(OH)2,在氢氧化镁中加盐酸溶解得到氯化镁溶液,蒸发得到MgCl2,在含有[Zn(OH)4]2-的溶液中加盐酸,调节pH,使其转化为氢氧化锌沉淀,
(1)根据HCO3-能发生水解反应分析;
(2)根据流程分析判断Y;由图2可知当pH<12时,[Zn(OH)4]2-的浓度小于10-5mol/L,当pH<8时会转化为锌离子;
(3)在溶液中加热促进MgCl2水解生成Mg(OH)2,灼烧Mg(OH)2分解生成MgO;
(4)由图2可知pH=7时,c(Zn2+)=10-3mol/L,根据Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)计算.
解答 解:海水中的成分为Na+、Ca2+、Mg2+、HCO3-、Zn2+,加氢氧化钠,与HCO3-反应生成CO32-再和Ca2+结合生成沉淀A碳酸钙,过滤,滤液中含有Na+、Mg2+、Zn2+,再加氢氧化钠溶液调节pH=11,Mg2+和Zn2+转化为沉淀B,则沉淀B为Mg(OH)2和Zn(OH)2,在沉淀B中加足量氢氧化钠,Zn(OH)2转化为[Zn(OH)4]2-,过滤,滤液为含有[Zn(OH)4]2-的溶液,滤渣为Mg(OH)2,在氢氧化镁中加盐酸溶解得到氯化镁溶液,蒸发得到MgCl2,在含有[Zn(OH)4]2-的溶液中加盐酸,调节pH,使其转化为氢氧化锌沉淀,
(1)海水中含有HCO3-,HCO3-能发生水解反应,离子方程式为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性,溶液的pH大于7,
故答案为:>;HCO3-+H2O?H2CO3+OH-;
(2)根据流程分析可知X为氢氧化钠溶液,Y为HCl;由图2可知当pH<12时,[Zn(OH)4]2-的浓度小于10-5mol/L,当pH<8时会转化为锌离子,则调节的pH的范围为8<pH<12,
故答案为:HCl;8<pH<12;
(3)在溶液中加热促进MgCl2水解生成Mg(OH)2,灼烧Mg(OH)2分解生成MgO,发生的反应分别为:MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;所以把MgCl2溶液蒸发、灼烧所得的白色固体为MgO,
故答案为:MgO;MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;
(4)由图2可知pH=7时,c(Zn2+)=10-3mol/L,则c(OH-)=10-7mol/L,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=10-17,
故答案为:10-17.
点评 本题考查性质方案的设计,题目难度中等,涉及物质的分离提纯、工艺流程的分析、盐的水解原理的应用、溶度积常数的计算等知识,正确分析制备流程为解答关键,试题培养了学生的分析能力及化学实验能力.

| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用惰性电极电解氯化钠溶液:4Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cl2↑+2H2↑+O2↑ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NaHCO3溶液中与滴加少量Ca(OH)2溶液:CO32-+Ca2+═CaCO3↓ |
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是B、E.
A.2mol/LNa2CO3溶液 B.品红溶液 C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2 E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
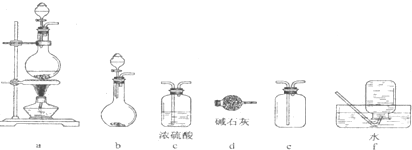
| A. | 加热浓硫酸和乙醇的混合物至170℃制备收集C2H4:连接a→d→f | |
| B. | 制备收集NO2:连接a→c→f | |
| C. | 制备收集Cl2:连接a→d→e | |
| D. | 制备收集NH3:连接b→d→e |
| A. | 石墨转化为金刚石 | B. | NaCl晶体熔化 | ||
| C. | 干冰升华 | D. | HCl溶于水 |