��Ŀ����
4���ߴ�̼�����ڵ��ӹ�ҵ������Ҫ��Ӧ�ã�ʪ���������̿���Ҫ�ɷ�ΪMnO2��������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̵�ʵ��������£�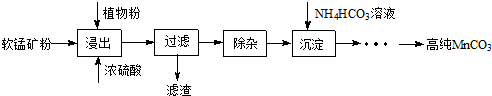
��1������������ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ����������̿����̵Ľ����ʣ�ֲ��۵�����������ԭ����
��2�����ӣ��������Һ�м���һ������̼���̿��ڽ���Һ��pHΪ3.5��5.5��
���ټ���һ���������̿��˫��ˮ�����ˣ�
�ۡ�
��������ʹ��̼���̵�pH�������ǣ��������м���˫��ˮ�����ܽ�Fe2+����ΪFe3+��������������̿�Ľ����ʣ�д��˫��ˮ������̿�����ʵ����ӷ���ʽMnO2+H2O2+2H+=Mn2++2H2O+O2����
��3���Ʊ�����30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3�������¶ȿ���35�����µ�ԭ���Ǽ���̼����淋ķֽ⣬���ԭ�������ʣ��÷�Ӧ�Ļ�ѧ����ʽΪMnSO4+2NH4HCO3 $\frac{\underline{\;30-35��\;}}{\;}$MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ�ε�ϴ����Һ1��2mL���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
��4�����㣺�����£�Ksp��MnCO3��=1.8��10-11��Ksp��MgCO3��=2.6��10-5����֪����Ũ��С��1.0��10-5mol•L-1ʱ����ʾ�����ӳ�����ȫ��������Һ�е�c��Mg2+��=10-2mol/L���Լ���˵��Mg2+�Ĵ����Ƿ��Ӱ��MnCO3�Ĵ��ȣ�
���� ʪ���������̿���Ҫ�ɷ�ΪMnO2��������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣�
��1�����½��趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ֲ�����һ�ֻ�ԭ����
��2��ʹ��̼���̵�pH�������Dz������µ����ʣ���������������������Ϊ��������������ԭΪ�����ӣ�
��3������̼����������ֽ��������30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�
��4��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=1.8��10-11/1.0��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��c��Mg2+����2.6��10-5/1.8��10-6=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1���ݴ˴��⣮
��� �⣺ʪ���������̿���Ҫ�ɷ�ΪMnO2��������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣�
��1�����¡����趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ����������̿����̵Ľ����ʣ�����ֲ�����һ�ֻ�ԭ����
�ʴ�Ϊ��������̿����̵Ľ����ʣ�����ԭ����
��2��ʹ��̼���̵�pH�������Dz������µ����ʣ�������Һ�ж�������������������Ϊ��������������ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��MnO2+H2O2+2H+=Mn2++2H2O+O2����
�ʴ�Ϊ������MnCO3�IJ������������µ����ʵȣ��� MnO2+H2O2+2H+=Mn2++2H2O+O2����
��3������̼����������ֽ�������¶ȿ���35�����µ�ԭ���Ƿ�ֹ̼����立ֽ⣬��30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪMnSO4+2NH4HCO3 $\frac{\underline{\;30-35��\;}}{\;}$MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
�ʴ�Ϊ������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3 $\frac{\underline{\;30-35��\;}}{\;}$MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
��4��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=$\frac{1.8��10{\;}^{-11}}{1.0}$��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10-5/1.8��10-6=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��������Һ�е�c��Mg2+��=10-2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=$\frac{1.8��10{\;}^{-11}}{1.0}$��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10-5/1.8��10-6=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��������Һ�е�c��Mg2+��=10-2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
���� ���⿼����������ᴿ���ۺ�Ӧ�ã�Ϊ��Ƶ���㣬�������̷������������뷽���������ķ�ӦΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�

��1������ұ�������̵�һ�ַ��������������̿�����Mn3O4�����������ȷ�Ӧԭ���Ƶ��̣������ȷ�Ӧ�Ļ�ѧ����ʽΪ8Al+3Mn3O4$\frac{\underline{\;����\;}}{\;}$4Al2O3+9Mn��
��2���ִ�ұ�������̵�һ�ֹ�����������ͼ��ʾ��
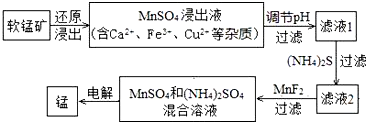
�±�Ϊt��ʱ���й����ʵ�pKsp��ע��pKsp=-lgKsp����
| ���� | Fe��OH��3 | Cu��OH��2 | Ca��OH��2 | Mn��OH��2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
12MnO2+C6H12O6+12H2SO4=12MnSO4+CO2��+18H2O
�ٸ÷�Ӧ�У���ԭ��ΪC6H12O6��д��һ�������ԭ�������ʵĴ�ʩ�����߷�Ӧ�¶Ȼ����̿���ϸ�ȣ�
����Һ1��pH�������������������=����MnSO4����Һ��pH��
�ۼ���MnF2����ҪĿ���dz�ȥCa2+����Ca2+��Fe3+��Cu2+��
��3����MnSO4��ȡMnCO3
��MnSO4��Һ�м������NH4HCO3��Һ���÷�Ӧ�����ӷ���ʽΪMn2++2HCO3-=MnCO3��+H2O+CO2��������MnSO4��Һ�м��루NH4��2CO3��Һ���������Mn��OH��2�����ܵ�ԭ���У�MnCO3��s��+2OH-��aq��?Mn��OH��2��s��+CO32-��aq����t��ʱ������÷�Ӧ��ƽ�ⳣ��K=100������ֵ����
| A�� | ����Ϊͬ���칹������ʲ����ܾ�����ͬ��ͨʽ | |
| B�� | ������ͬ�����ŵ��л��ﲻһ����ͬϵ�� | |
| C�� | ���ࡢ��֬�������ʶ��ǽ���C��H��OԪ�ص��л��� | |
| D�� | ȼ�ղ�����CO2��H2O���л���һ������ |
Ksp��CaCO3��=2.8��10-9��Ksp��MgCO3��=6.8��10-6��Ksp[Mg��OH��2]=1.8��10-11��
| ��ˮ�ɷ� | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| ����/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |

[����٢ڹ�����Һ������䣬���Է�����̵���ʧ]
��1��25��ʱ��ú�ˮ��pH�� 7.0�����������������������������ԭ����HCO3-+H2O?H2CO3+OH-��д���ӷ���ʽ����
��2����ͼΪ��ҺpH���Ӧ��Zn2+��[Zn��OH��4]2-���ʵ���Ũ�ȵĶ�������ͼ������ͼ�����ݻش��Լ�Y�Ļ�ѧʽΪHCl������ҺF������C���̣�һ����Ϊ����Ũ�ȵ���10-5mol/L���dz�����ȫ��������ڵ�pH��ΧΪ8��pH��12��

��3��ͬѧ�Ƿ��֣���MgCl2��Һ���ɡ��������õİ�ɫ����������ˮ������Ϊ����Ҫ�ɷ���MgO��ԭ���ǣ��û�ѧ����ʽ��ʾ��MgCl2+2H2O$\frac{\underline{\;\;��\;\;}}{\;}$Mg��OH��2��+2HCl����Mg��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$MgO+H2O��
��4����ͼ��c��Zn2+������Zn��OH��2���ܶȻ�Ksp=10-17��
| Zn������ | H2SO4��Ũ�� | �ռ�20mL H2�����ʱ�� | |
| �� | 12g����� | 0.1mol/L | 153s |
| �� | 10g��п�ۣ� | 0.1mol/L | 125s |
| �� | 10g��п�ۣ� | 0.2mol/L | 62s |
��2��д���÷�Ӧ�Ļ�ѧ����ʽZn+H2SO4=ZnSO4+H2�����÷�Ӧ�л�ԭ����Zn���ӷ�Ӧ����Ƕ��������÷�Ӧ������������ԭ��Ӧ���������û���Ӧ�����Ĵ������Ӧ����֮һ����

| A�� | ���л���ķ���ʽΪC12H14NO4 | |
| B�� | ���л���ȿ������ᷴӦ���ֿ���NaOH��Һ��Ӧ | |
| C�� | ���л����к���2������̼ԭ�� | |
| D�� | 1mol���л������ֻ����1molBr2����ȡ����Ӧ |
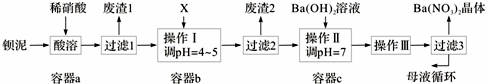
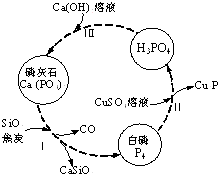 �������仯�����ڿ��м������о�������Ҫ��Ӧ�ã�
�������仯�����ڿ��м������о�������Ҫ��Ӧ�ã�