题目内容
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知
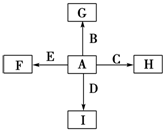
①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质.
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性.
回答问题:
(1)化合物K的电子式为 ;
(2)F的水溶液呈碱性的原因(用离子方程式表示) ;写出I与J反应的化学反应方程式 ;
(3)实验室制备C的离子反应方程式为 ;
(4)D在C中燃烧观察到的现象是 .
(5)可利用B与D生成化合物J的反应制成燃料电池,若1g D在B中燃烧生成气态J时,放出120.9kJ的热量,已知1molJ在汽化时吸热44.0kJ,写出表示D的燃烧热的热化学方程式: .利用K作电解质溶液,写出该燃料电池的负极的电极反应方程式: .

①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质.
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性.
回答问题:
(1)化合物K的电子式为
(2)F的水溶液呈碱性的原因(用离子方程式表示)
(3)实验室制备C的离子反应方程式为
(4)D在C中燃烧观察到的现象是
(5)可利用B与D生成化合物J的反应制成燃料电池,若1g D在B中燃烧生成气态J时,放出120.9kJ的热量,已知1molJ在汽化时吸热44.0kJ,写出表示D的燃烧热的热化学方程式:
考点:无机物的推断
专题:推断题
分析:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置,则A为Na;有色气体单质C与K反应的产物含漂白液的有效成分,则C为Cl2,K为NaOH,可推知H为NaCl;B与D可以生成化合物J,A(Na)与J反应生成D和另一种化合物K(NaOH),应是钠与水反应,可推知B为O2、D为H2、J为H2O,则I为NaH、G为氧化钠或过氧化钠;有色固体单质E与Na反应生成F,F的水溶液为碱性,可推知E为硫,F为Na2S,据此解答.
解答:
解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置,则A为Na;有色气体单质C与K反应的产物含漂白液的有效成分,则C为Cl2,K为NaOH,可推知H为NaCl;B与D可以生成化合物J,A(Na)与J反应生成D和另一种化合物K(NaOH),应是钠与水反应,可推知B为O2、D为H2、J为H2O,则I为NaH、G为氧化钠或过氧化钠;有色固体单质E与Na反应生成F,F的水溶液为碱性,可推知E为硫,F为Na2S,
(1)化合物K为NaOH,其电子式为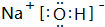 ,故答案为:
,故答案为: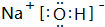 ;
;
(2)Na2S的水溶液硫离子水解:S2-+H2O?HS-+OH-,破坏水的电离平衡,溶液呈碱性;
NaH与水反应生成氢氧化钠与氢气,化学反应方程式为:NaH+H2O=NaOH+H2↑,
故答案为:S2-+H2O?HS-+OH-;NaH+H2O=NaOH+H2↑;
(3)实验室制备氯气的离子反应方程式为:MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O;
(4)氢气在氯气中燃烧观察到的现象是:苍白色火焰,并伴有白雾生成,
故答案为:苍白色火焰,并伴有白雾生成;
(5)若1g 氢气在氧气中燃烧生成气态水时,放出120.9kJ的热量,生成1mol氢气完全燃烧生成气态水时发出的热量=120.9kJ×
=241.8kJ,1mol水在汽化时吸热44.0kJ,故1mol氢气生成液态水放出的热量=241.8kJ+44kJ=285.8kJ,则氢气燃烧热的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,
负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol;H2-2e-+2OH-=2H2O.
(1)化合物K为NaOH,其电子式为
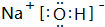 ,故答案为:
,故答案为: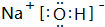 ;
;(2)Na2S的水溶液硫离子水解:S2-+H2O?HS-+OH-,破坏水的电离平衡,溶液呈碱性;
NaH与水反应生成氢氧化钠与氢气,化学反应方程式为:NaH+H2O=NaOH+H2↑,
故答案为:S2-+H2O?HS-+OH-;NaH+H2O=NaOH+H2↑;
(3)实验室制备氯气的离子反应方程式为:MnO2+4H++2 Cl-
| ||
故答案为:MnO2+4H++2 Cl-
| ||
(4)氢气在氯气中燃烧观察到的现象是:苍白色火焰,并伴有白雾生成,
故答案为:苍白色火焰,并伴有白雾生成;
(5)若1g 氢气在氧气中燃烧生成气态水时,放出120.9kJ的热量,生成1mol氢气完全燃烧生成气态水时发出的热量=120.9kJ×
| 1mol×2g/mol |
| 1g |
| 1 |
| 2 |
负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O,
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题考查无机物推断,金属A的焰色反应为推断突破口,需要学生熟练掌握元素化合物性质,(5)中关键是计算反应热,为易错点,学生溶液忽略是燃烧热的热化学方程式,难度中等.

练习册系列答案
相关题目
有 Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是( )
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
下列条件下,离子能大量共存或者离子方程式正确的是( )
| A、pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C、一小块钠投入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ |
| D、铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
 按要求完成下列小题.
按要求完成下列小题. 填写下列空白:
填写下列空白: ,请回答下列问题:
,请回答下列问题: