题目内容
下列解释实验现象的反应方程式正确的是( )
| A、SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO4+H2O | ||||
| B、向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72-+H2O?2CrO42-+2H+ | ||||
| C、等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ | ||||
D、铝热反应的原理为:Al2O3+2Fe
|
考点:离子方程式的书写,化学方程式的书写
专题:化学用语专题
分析:A.反应生成亚硫酸钠和水;
B.加入少量NaOH浓溶液,使Cr2O72-+H2O?2CrO42-+2H+平衡正向移动;
C.1:2体积比混合,生成硫酸钡、氢氧化铝、一水合氨;
D.铝热反应为Al与金属氧化物反应.
B.加入少量NaOH浓溶液,使Cr2O72-+H2O?2CrO42-+2H+平衡正向移动;
C.1:2体积比混合,生成硫酸钡、氢氧化铝、一水合氨;
D.铝热反应为Al与金属氧化物反应.
解答:
解:A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅的反应为SO2+2NaOH=Na2SO3+H2O,故A错误;
B.加入少量NaOH浓溶液,使Cr2O72-+H2O?2CrO42-+2H+平衡正向移动,溶液由橙色变为黄色,故B正确;
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3.H2O,故C错误;
D.铝热反应的原理为:2Al+Fe2O3
Al2O3+2Fe,故D错误;
故选B.
B.加入少量NaOH浓溶液,使Cr2O72-+H2O?2CrO42-+2H+平衡正向移动,溶液由橙色变为黄色,故B正确;
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3.H2O,故C错误;
D.铝热反应的原理为:2Al+Fe2O3
| ||
故选B.
点评:本题考查较为综合,涉及平衡移动、化学反应及离子反应的书写,明确发生的化学反应是解答本题的关键,注意选项C为解答的难点,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为( )


| A、CH3COOH;HCl;CH3COONa |
| B、HCl;CH3COOH;CH3COONa |
| C、NH4Cl;CH3COOH;NaOH |
| D、NH4Cl;HCl;NaHCO3 |
下列溶液中的Na+与50mL 1mol?L-1 Na3PO3溶液中Na+的物质的量浓度相等的是( )
| A、150mL 3mol?L-1 NaCl溶液 |
| B、75mL 2mol?L-1 NaNO3溶液 |
| C、150mL 2mol?L-1 Na2SO4溶液 |
| D、75mL 1mol?L-1的Na2S溶液 |
下列各组离子一定能大量共存的是( )
| A、含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+ |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+ |
| D、pH=7的溶液:Fe3+、Mg2+、SO42-、Cl- |
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4L乙醇中含有的碳原子数目为2NA |
| B、1mol CnH2n含有的共同电子对数为(3n+1)NA |
| C、1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA |
| D、1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA |
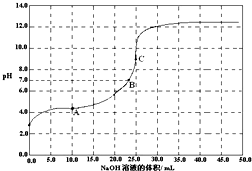 常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )
常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )| A、滴定前,酸中c(H+) 等于碱中c(OH-) |
| B、在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-) |
| C、在B点,两者恰好完全反应 |
| D、在C点,c(X-)+c(HX)=0.05 mol/L |
常温下,将1.92g Cu加入l00mL硫酸和硝酸的混合溶液中,铜全部溶解并放出无色气体,再向该溶液中加入足量的Fe粉充分反应,此时收集到的气体全部是氢气且在标准状况下的体积为448mL.下列说法中正确的是( )
A、原混合液中n(N
| ||
B、原混合液中c(S
| ||
| C、原混合液中pH=1-lg1.2 | ||
| D、溶解的Fe粉质量为2.8g |
 氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究