��Ŀ����
��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵����Ͳ��ϣ���ҵ����CO�����״���һ�������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4molH2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯ͼ����ش��������⣺
��1���ڡ�ͼ1���У����� ���a����b������ʾʹ���˴������÷�Ӧ���� ������ȡ����ȡ�����Ӧ��
��2�����ݡ�ͼ2���жϣ�����˵������ȷ����
A����ʼ�����COΪ1mol
B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵﵽƽ��״̬
D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1mol CO��2mol H2�����ٴδﵽƽ��ʱ
������
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��H2��= �����¶���CO��g��+2H2��g��?CH3OH��g���Ļ�ѧƽ�ⳣ��Ϊ �������������������䣬����Ӧ��ϵ���£���÷�Ӧ�Ļ�ѧƽ�ⳣ���� �����������С�����䡱����
��4�����ڡ�ͼ3���л���ƽ��ʱ�״������ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2����P1��P2������
��5����ѧ�ҳ��� �����������ƣ���ֱ�Ӳⶨijһ��Ӧ�ķ�Ӧ�ȣ��ֲ�ã�CH3OH��g��+
O2=CO2��g��+2H2O��g����H=-192.9KJ/mol����֪H2O��l��=H2O��g����=44KJ/mol����д��32g��CH3OH��g����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ��

��1���ڡ�ͼ1���У�����
��2�����ݡ�ͼ2���жϣ�����˵������ȷ����
A����ʼ�����COΪ1mol
B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵﵽƽ��״̬
D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1mol CO��2mol H2�����ٴδﵽƽ��ʱ
| n(CH3)OH |
| n(CO) |
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��H2��=
��4�����ڡ�ͼ3���л���ƽ��ʱ�״������ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2����P1��P2������
��5����ѧ�ҳ���
| 3 |
| 2 |

���㣺��ѧƽ��ļ���,�Ȼ�ѧ����ʽ,��ѧƽ�⽨���Ĺ���,��ѧƽ��ĵ�������
ר�⣺��ѧƽ��ר��
��������1�����ݻ�ܵĴ�С�жϣ����ݷ�Ӧ������������������жϣ�
��2����Ӧ����ʽΪCO��g��+2H2��g��?CH3OH��g�������ݷ���ʽ���ͼ������жϣ�
��3�������CO�ķ�Ӧ���ʣ���Ϸ���ʽ�ɼ��������ķ�Ӧ���ʣ������ƽ��ʱ�����ʵ�Ũ�ȣ��ɼ����ƽ�ⳣ��������Ӧ���ȣ������¶�ƽ�ⳣ����С��
��4������ѹǿ��ƽ���ƶ���Ӱ���жϣ�
��5��32g��CH3OH�����ʵ���Ϊ1mol����ϸ�˹���ɼ��㣮
��2����Ӧ����ʽΪCO��g��+2H2��g��?CH3OH��g�������ݷ���ʽ���ͼ������жϣ�
��3�������CO�ķ�Ӧ���ʣ���Ϸ���ʽ�ɼ��������ķ�Ӧ���ʣ������ƽ��ʱ�����ʵ�Ũ�ȣ��ɼ����ƽ�ⳣ��������Ӧ���ȣ������¶�ƽ�ⳣ����С��
��4������ѹǿ��ƽ���ƶ���Ӱ���жϣ�
��5��32g��CH3OH�����ʵ���Ϊ1mol����ϸ�˹���ɼ��㣮
���
�⣺��1������������ɽ��ͷ�Ӧ�Ļ�ܣ���ͼ���֪b��ܽϵͣ�Ӧ�����������Ӧ������������������������������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��b�����ȣ�
��2��A��CO����ʼŨ��Ϊ1moL/L�����Ϊ2L������ʼ�����COΪ2mol����A����
B������COŨ�ȣ�CO��ת���ʼ�С����B����
C�����ڷ�Ӧǰ�������������ȣ���������ѹǿ�㶨ʱ����Ӧ�Ѵﵽƽ��״̬����C��ȷ��
D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1mol CO��2mol H2���൱����ԭ���Ļ�������С�����ѹǿ����ƽ��������Ӧ�����ƶ�����ƽ��ʱ
������D��ȷ��
�ʴ�Ϊ��AB��
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��CO��=
=0.075moL/��L?min����
��v��H2��=2v��CO��=0.15moL/��L?min����
ƽ��ʱ��c��CO��=0.25mol/L��c��CH3OH��=0.75mol/L��
������n��CO��=0.75mol/L��2L=1.5mol�����ĵ�n��H2��=3mol��
ƽ��ʱc��H2��=
=0.5mol/L��
k=
=12��
����Ӧ���ȣ������¶�ƽ�ⳣ����С��
�ʴ�Ϊ��0.15moL/��L?min����12����С��
��4������ѹǿ��ƽ��������Ӧ�����ƶ�����״��İٷֺ��������¶����ߣ�ƽ�����淴Ӧ�����ƶ����״��İٷֺ������ͣ���ͼ���Ϊ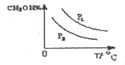 ��
��
�ʴ�Ϊ�� ��
��
��5����ѧ�ҳ������ȼ���ֱ�Ӳⶨijһ��Ӧ�ķ�Ӧ�ȣ�
��֪��CH3OH��g��+
O2=CO2��g��+2H2O��g����H=-192.9KJ/mol����H2O��l��=H2O��g����=44KJ/mol��
���ø�˹���ɽ���-�ڡ�2�ɵ�CH3OH��g��+
O2��g��=CO2��g��+2H2O��l��
��H=��-192.9kJ/mol��-44KJ/mol��2=-280.9kJ/mol��
�ʴ�Ϊ�����ȼƣ�CH3OH��g��+
O2��g��=CO2��g��+2H2O��l����H=-280.9kJ/mol��
��2��A��CO����ʼŨ��Ϊ1moL/L�����Ϊ2L������ʼ�����COΪ2mol����A����
B������COŨ�ȣ�CO��ת���ʼ�С����B����
C�����ڷ�Ӧǰ�������������ȣ���������ѹǿ�㶨ʱ����Ӧ�Ѵﵽƽ��״̬����C��ȷ��
D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1mol CO��2mol H2���൱����ԭ���Ļ�������С�����ѹǿ����ƽ��������Ӧ�����ƶ�����ƽ��ʱ
| n(CH3)OH |
| n(CO) |
�ʴ�Ϊ��AB��
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��CO��=
| 1mol/L-0.25mol/L |
| 10min |
��v��H2��=2v��CO��=0.15moL/��L?min����
ƽ��ʱ��c��CO��=0.25mol/L��c��CH3OH��=0.75mol/L��
������n��CO��=0.75mol/L��2L=1.5mol�����ĵ�n��H2��=3mol��
ƽ��ʱc��H2��=
| 4mol-3mol |
| 2L |
k=
| 0.75 |
| 0.25��0��52 |
����Ӧ���ȣ������¶�ƽ�ⳣ����С��
�ʴ�Ϊ��0.15moL/��L?min����12����С��
��4������ѹǿ��ƽ��������Ӧ�����ƶ�����״��İٷֺ��������¶����ߣ�ƽ�����淴Ӧ�����ƶ����״��İٷֺ������ͣ���ͼ���Ϊ
 ��
���ʴ�Ϊ��
 ��
����5����ѧ�ҳ������ȼ���ֱ�Ӳⶨijһ��Ӧ�ķ�Ӧ�ȣ�
��֪��CH3OH��g��+
| 3 |
| 2 |
���ø�˹���ɽ���-�ڡ�2�ɵ�CH3OH��g��+
| 3 |
| 2 |
��H=��-192.9kJ/mol��-44KJ/mol��2=-280.9kJ/mol��
�ʴ�Ϊ�����ȼƣ�CH3OH��g��+
| 3 |
| 2 |
���������⿼���Ϊ�ۺϣ��漰��ѧƽ��ļ��㡢��ѧƽ����ƶ��Լ�Ӱ�����ء���ѧ��Ӧ�������仯�����⣬��Ŀ�Ѷ��еȣ�ע���˹���ɵ������Լ���ѧƽ�ⳣ�������壮

��ϰ��ϵ�д�
�����Ŀ
�����������£�һ���ܴ���������������ǣ�������
| A��ˮ���������H+Ũ��Ϊ1��10-12mol/L����Һ��NH4+��Na+��Cl-��HCO3- |
| B�����д���Fe3+����Һ��SCN-��I-��K+��Br- |
| C��ʹpH��ֽ�ʺ�ɫ����Һ�У�Fe3+��NO3-��SO42-��Na+ |
| D����Al��Ӧ�ų�������������Һ�У�NH4+��SO42-��CO32-��Na+ |
 ij�������õ�ⷨ����������ˮ�������������������������������ʢ�ź�����ˮ��ԭ��ʾ��ͼ��ͼ������˵������ȷ���ǣ�������
ij�������õ�ⷨ����������ˮ�������������������������������ʢ�ź�����ˮ��ԭ��ʾ��ͼ��ͼ������˵������ȷ���ǣ�������| A��AΪ��Դ���� |
| B����������Һ�з�����������ԭ��ӦΪ��Cr2O72-+6Fe2++14H+�T2Cr3++6Fe3++7H2O |
| C��������������ҺpH���� |
| D����������������ܽ⣬���ռ���H213.44 L����״����ʱ����0.1 mol Cr2O72-����ԭ |
NA��ʾ����٤������������������ȷ���ǣ�������
| A��1 mol Cu������Ũ���ᷴӦ���ռ�NO2�ķ�����Ϊ2 NA |
| B��4��ʱ��3.6 mL ˮ�����ĵ�����Ϊ2 NA |
| C��30.8 g��ʯ�ࣨ2CaSO4?H2O���еĸ�������ĿΪ0.20 NA |
| D��200 mL 0.5 mol?L-1��Na2CO3��Һ����������ĿС��0.1 NA |
���н���ʵ������ķ�Ӧ����ʽ��ȷ���ǣ�������
| A��SO2ͨ�뵽�μӷ�̪��NaOH��Һ�У���ɫ��dz��SO2+2NaOH=Na2SO4+H2O | ||||
| B����K2Cr2O7��Һ�м�������NaOHŨ��Һ����Һ�ɳ�ɫ��Ϊ��ɫ��Cr2O72-+H2O?2CrO42-+2H+ | ||||
| C����Ũ�ȵ�NH4Al��SO4��2��Һ��Ba��OH��2��Һ��1��2����Ȼ�ϳ��ְ�ɫ������Al3++2SO42-+2Ba2++3OH-=2BaSO4��+Al��OH��3�� | ||||
D�����ȷ�Ӧ��ԭ��Ϊ��Al2O3+2Fe
|
 ij���Ӿ��徧���ṹ��ͼ������Xλ��������Ķ��㣬����Yλ������������ģ��Է�����
ij���Ӿ��徧���ṹ��ͼ������Xλ��������Ķ��㣬����Yλ������������ģ��Է�����