题目内容
20.25℃时,在0.1mol/LNaX溶液中,水的电离度为α1;在0.1mol/L盐酸中,水的电离度为α2,若$\frac{{α}_{1}}{{α}_{2}}$=109,则NaX溶液的pH值为( )| A. | 5 | B. | 7 | C. | 10 | D. | 11 |
分析 根据电离度之比等于溶液中水电离的氢氧根离子浓度之比,求出水电离的氢离子浓度,再求出pH,以此解答该题.
解答 解:水的电离度之比等于溶液中水电离的氢氧根离子浓度之比,则在0.1mol/L盐酸中水电离的氢氧根离子浓度为10-13mol/L,若$\frac{{α}_{1}}{{α}_{2}}$=109,则0.1mol/LNaR的溶液中水的电离的氢氧根离子浓度为10-13mol/L×109=10-4mol/L,所以0.1mol/LNaR的溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,所以pH=10.
故选C.
点评 本题考查了弱电解质的电离、盐类的水解等知识点,为高频考点,试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力,题目难度中等.

练习册系列答案
相关题目
10.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质可能具有半导体的特性 |
5.下列物质熔点变化顺序中,不正确的是 ( )
| A. | NaF>NaCl>NaBr>Nal | B. | NaCl<MgC12<AlCl3>SiCl4 | ||
| C. | LiF>NaCl>KBr>Csl | D. | Al2O3>MgO>CaO>BaO |
4.某有机物的结构简式如图所示,其名称正确的是( )


| A. | 2-乙基戊烷 | B. | 2,3-二甲基庚烯 | ||
| C. | 2,3-二甲基-5-庚烯 | D. | 2,2,3,4-四甲基戊烷 |
 现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:
现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题: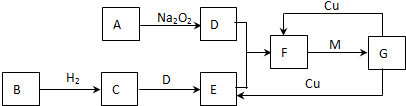
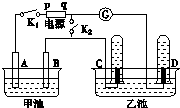 在如图所示均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:
在如图所示均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题: