题目内容
5.下列物质熔点变化顺序中,不正确的是 ( )| A. | NaF>NaCl>NaBr>Nal | B. | NaCl<MgC12<AlCl3>SiCl4 | ||
| C. | LiF>NaCl>KBr>Csl | D. | Al2O3>MgO>CaO>BaO |
分析 A、结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
B、离子晶体的熔点高于分子晶体;
C、结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
D、结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高.
解答 解:A、离子半径:F-<Cl-<Br-<I-,结构相似的离子晶体,离子半径越小,晶格能越大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,所以熔点:NaF>NaCl>NaBr>NaI,故A正确;
B、NaCl和MgC12是离子晶体,而AlCl3和SiCl4是分子晶体,所以熔点的高低为:MgC12>NaCl>AlCl3>SiCl4,故B错误;
C、阴离子半径:F-<Cl-<Br-<I-,阳离子半径:Li+<Na+<K+<Cs+,所以熔点LiF>NaCl>KBr>Csl,故C正确;
D、阳离子半径:Al3+<Mg2+<Ca2+<Ba2+,所以对应氧化物熔点的高低为Al2O3>MgO>CaO>BaO,故D正确;
故选B.
点评 本题考查晶体的组成、晶格能和熔点的大小比较,题目难度中等,学习中注意把握常见晶体的结构以及影响性质的因素.

练习册系列答案
相关题目
15.下列常见的物质电离和提纯操作中,将液体蒸发为气体再冷凝为液体的操作是( )
| A. | 结晶 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
16.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )
| A. | 向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变 | |
| B. | 降低温度,KW减小,pH不变 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低 |
20.25℃时,在0.1mol/LNaX溶液中,水的电离度为α1;在0.1mol/L盐酸中,水的电离度为α2,若$\frac{{α}_{1}}{{α}_{2}}$=109,则NaX溶液的pH值为( )
| A. | 5 | B. | 7 | C. | 10 | D. | 11 |
2.丁烷广泛应用于家用液化石油气中,也用于打火机中作燃料.下列叙述不正确的是( )
| A. | 在常温下,丁烷是气体 | |
| B. | 丁烷与甲烷互为同系物 | |
| C. | 丁烷有正丁烷和异丁烷两种同分异构体 | |
| D. | 戊烷进行一氯取代后生成两种沸点不同的产物 |
9.实验室保存下列化学试剂的方法有错误的是( )
| A. | 水玻璃保存在用橡皮塞的玻璃试剂瓶中 | |
| B. | 氢氟酸保存在用橡皮塞的玻璃试剂瓶中 | |
| C. | 固体烧碱放在广口塑料瓶中并且塑料盖盖严 | |
| D. | 液溴密封盛放在棕色瓶中,液面放一层水 |
6.提出元素周期律并绘制了第一个元素周期表的科学家是( )
| A. | 盖斯 | B. | 阿伏加德罗 | C. | 门捷列夫 | D. | 道尔顿 |
7.X2-与Y+离子都与Ar原子具有相同的核外电子排布,则下列叙述中正确的是( )
| A. | 原子序数X>Y | B. | 离子半径X>Y | ||
| C. | X和Y一定在同一周期 | D. | X是第IIA族元素,Y是第VIIA族元素 |
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.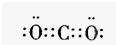 .
.