题目内容
10.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质可能具有半导体的特性 |
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,设W的最外层电子数为x,则X、Y、Z最外层电子数分别为x+1、x+2、x+3,则:x+x+1+x+2+x+3=22,解得:x=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,据此结合元素周期律知识解答.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,设W的最外层电子数为x,则X、Y、Z最外层电子数分别为x+1、x+2、x+3,则:x+x+1+x+2+x+3=22,解得:x=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,
A.X、Y、Z三种元素最低价氢化物分别为氨气、水、HCl,常温下水为液态,氨气、HCl为气体,故水的沸点最高,氨气分子之间都存在氢键,沸点比HCl的高,故A错误;
B.N、O和H形成的化合物硝酸铵中既有离子键、又有共价键,故B错误;
C.物质WY2、W3X4、WZ4分别为SiO2、Si3N4、SiCl4,SiO2、Si3N4为原子晶体,具有有熔点高、硬度大的特性,而SiCl4为共价化合物,其熔点较低、硬度较小,故C错误;
D.Ge的最外层电子数为4,位于金属与非金属的交界处,可知T元素的单质具有半导体的特性,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,为高频考点,题目难度不大,把握原子结构、元素的位置与性质、元素周期律为解答的关键,试题综合性较强,侧重分析与应用能力的考查.

练习册系列答案
相关题目
20.某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
| A. | 分子中的C、H、O的个数比为1:2:3 | |
| B. | 分子中C、H个数比为1:2 | |
| C. | 该有机物的相对分子质量为14的倍数 | |
| D. | 该分子中肯定不含氧元素 |
1.下列物质不属于同素异形体的是( )
| A. | 金刚石和石墨 | B. | 氧气和臭氧 | ||
| C. | 红磷和白磷 | D. | 氢氧化钠和氢氧化钾 |
5.某有机物的分子式为C4H8O2,有关其同分异构体数目的说法错误的是( )
| A. | 属于酯类的有4种 | B. | 属于羧酸的有2种 | ||
| C. | 既含有羟基又含有醛基的有3种 | D. | 含有六元环状结构的分子不止一种 |
15.下列常见的物质电离和提纯操作中,将液体蒸发为气体再冷凝为液体的操作是( )
| A. | 结晶 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
2.在同温同压下,某有机物和过量Na反应得到V1L氢气,另一份等质量的有机物和足量的NaHCO3反应得到V2L二氧化碳,若2V1=V2则有机物可能是( )
| A. |  | B. | HOOC-COOH | C. | HOCH2CH2OH | D. | 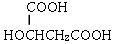 |
 已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题: