题目内容
11. 现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:
现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:(1)在A、B、C、D四种元素中第一电离能最小的是Al,电负性最大的是O (用相应的元素符号表示).
(2)写出DA2的水化物在水中的电离方程式H2SO3?H++HSO3-.DA3是非极性分子(填“极性”或“非极性”).
(3)A、C的简单氢化物中,哪种物质的沸点高,原因是什么?H2O的沸点高;水分子间存在比分子间作用力大的氢键
(4)若[E(NH3)4]2+具有对称的空间构型,且当[E(NH3)4]2+中的两个NH3分子被两个Cl-取代时,能得到两种不同结构的产物,则[E(NH3)4]2+的空间构型为b (填序号).
a.正四面体 b.平面正方形 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为a pm,密度为dg•cm-3(1pm=10-10cm).写出阿伏加德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8{a}^{3}d}$.(用M、a、d表示)
分析 A基态原子最外层电子数是次外层的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则A为O元素;B基态原子核外有13种不同运动状态的电子,则B为Al元素;C与B同一周期,原子中未成对电子数是同周期中最多的,则C为P元素; D2-的核外电子排布与氩原子相同,则D为S元素;E元素的基态原子价电子排布式为3d104s1,则E为Cu元素,以此解答该题.
解答 解:A基态原子最外层电子数是次外层的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则A为O元素;B基态原子核外有13种不同运动状态的电子,则B为Al元素;C与B同一周期,原子中未成对电子数是同周期中最多的,则C为P元素; D2-的核外电子排布与氩原子相同,则D为S元素;E元素的基态原子价电子排布式为3d104s1,则E为Cu元素,
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以A、B、C、D四种元素的第一电离能最小的是Al元素,元素的非金属性越强其电负性越强,所以电负性最大的是O元素,
故答案为:Al;O;
(2)二氧化硫的水化物为H2SO3,为弱酸,电离方程式为H2SO3?H++HSO3-,δ含有3个δ键,没有孤电子对,为非极性分子,
故答案为:H2SO3?H++HSO3-;非极性;
(3)H2O中存在氢键,分子间作用较强,沸点较高,故答案为:H2O的沸点高;水分子间存在比分子间作用力大的氢键;
(4)若 Cu(NH3)42+具有对称的空间构型,且当 Cu(NH3)42+中的两个NH3分子被两个Cl取代时.能得到两种不同结构的产物,则 Cu(NH3)42+空间构型为平面正方形,
故答案为:b;
(5)质Cu晶胞中原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{M}{N{\;}_{A}}$g,原子半径为a pm,则晶胞棱长d=$\frac{\sqrt{2}}{2}$×4a=2$\sqrt{2}$a×10-10cm,则4×$\frac{M}{N{\;}_{A}}$g=(2$\sqrt{2}$a×10-10cm)3×dg/cm3,故NA=$\frac{\sqrt{2}×1{0}^{30}M}{8{a}^{3}d}$,
故答案为:$\frac{\sqrt{2}×1{0}^{30}M}{8{a}^{3}d}$.
点评 本题是对物质结构与性质的考查,为高考常见题型,涉及核外电子排布、电离能、电负性、分子结构与性质、空间构型与杂化方式、化学键、晶胞计算等,需要学生具备扎实的基础,注意同周期主族元素中第一电离能异常情况.

| A. | 金刚石和石墨 | B. | 氧气和臭氧 | ||
| C. | 红磷和白磷 | D. | 氢氧化钠和氢氧化钾 |
| A. |  | B. | HOOC-COOH | C. | HOCH2CH2OH | D. | 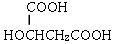 |
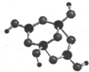
 在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )
在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅥA | B. | ⅢA | C. | ⅤA | D. | ⅣA |
| A. | 向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变 | |
| B. | 降低温度,KW减小,pH不变 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低 |
| A. | 5 | B. | 7 | C. | 10 | D. | 11 |
| A. | 溴乙烷 | B. | 溴苯 | ||
| C. | 乙醛 | D. | 高级脂肪酸甘油酯 |
 已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
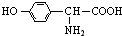 .
.