题目内容
8.将 4molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g),若经 2s后测得 C的浓度为 0.6mol•L-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3mol•L-1•s-1
②物质 B的体积分数是40%
③2s 时物质 A 的转化率为30%
④2s 时物质 B 的浓度为 1.0mol•L-1
其中正确的是( )
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ③④ |
分析 若经过2秒后测得C的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol
2A(g)+B(g)?2C(g)
起始量(mol) 4 3 0
变化量(mol) 1.2 0.6 1.2
2s量(mol) 2.8 2.4 1.2
据此分析计算,
①用物质A 表示反应的平均速率v=$\frac{△c}{△t}$,
②气体体积分数等于其物质的量分数,
③转化率=$\frac{变化量}{起始量}$×100%,
④浓度c=$\frac{n}{V}$.
解答 解:若经过2秒后测得C的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol
2A(g)+B(g)?2C(g)
起始量(mol) 4 3 0
变化量(mol) 1.2 0.6 1.2
2s量(mol) 2.8 2.4 1.2
据此分析计算,
①用物质A 表示反应的平均速率v=$\frac{△c}{△t}$=$\frac{\frac{1.2mol}{2L}}{2s}$=0.3(mol/L•s),故①正确,
②物质 B的体积分数=$\frac{2.4mol}{2.8mol+2.4mol+1.2mol}$×100%=37.5%,故②错误,
③2s 时物质 A 的转化率=$\frac{变化量}{起始量}$×100%=$\frac{1.2mol}{4mol}$×30%=30%,故③正确,
④2s 时物质 B 的浓度c=$\frac{n}{V}$=$\frac{2.4mol}{2L}$=1.2mol/L,故④错误,
故选C.
点评 本题考查了化学反应速率、体积分数、转化率的计算,注意单位的使用,掌握基础是关键,题目较简单.

| A. | 向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变 | |
| B. | 降低温度,KW减小,pH不变 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低 |
| A. | 5 | B. | 7 | C. | 10 | D. | 11 |
| A. | 水玻璃保存在用橡皮塞的玻璃试剂瓶中 | |
| B. | 氢氟酸保存在用橡皮塞的玻璃试剂瓶中 | |
| C. | 固体烧碱放在广口塑料瓶中并且塑料盖盖严 | |
| D. | 液溴密封盛放在棕色瓶中,液面放一层水 |
 已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
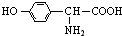 .
. 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.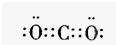 .
.