题目内容
2.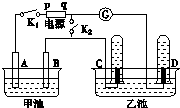 在如图所示均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:
在如图所示均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:(1)电解过程中,乙池C电极发生反应的电极反应式为2H++2e-═H2↑.
(2)甲池电解时反应的离子方程式2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+.
(3)甲池电解后溶液的pH=1,要使电解后溶液恢复到电解前的状态,则需加入CuO,其质量为2g.(假设电解前后溶液的体积不变)
(4)电解后若再将K1断开,闭合K2,电流计指针发生偏转,则D电极发生反应的电极反应式O2+4e-+4H+═2H2O.
分析 (1)A电极表面有红色的固态物质生成,所以A电极是阴极,B电极有无色气体生成,所以B是阳极,与阳极相连的是q为正极,p是负极,所以C是阴极,该电极产生的气体是氢气,D电极是阳极,该极上产生的是氧气,根据电极上离子的放电规律书写电极反应式;
(2)电解硫酸铜生成硫酸、铜和氧气,据此回答;
(3)根据生成的铜的量计算生成硫酸的量,进而计算pH,电解质复原的方法:出什么加什么;
(4)再将K1断开,闭合K2,电流计指针发生偏转,形成氢氧燃料电池,通氧气的是正极,发生得电子的还原反应.
解答 解:A电极表面有红色的固态物质生成,所以A电极是阴极,B电极有无色气体生成,所以B是阳极,与阳极相连的是q为正极,p是负极,所以C是阴极,该电极产生的气体是氢气,D电极是阳极,该极上产生的是氧气,
(1)电解过程中,乙池C电极是阴极,该电极发生反应的电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)电解硫酸铜生成硫酸、铜和氧气,甲池电解时反应的离子方程式为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+;
(3)取出A电极,洗涤、干燥、称量,电极质量增重1.6g,即生成金属铜的物质的量是0.025mol,根据2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,
生成硫酸中氢离子的物质的量是0.05mol,所以氢离子浓度是$\frac{0.05mol}{0.5L}$=0.1mol/L,pH=1,电解质复原的方法:出什么加什么,要使电解后溶液恢复到电解前的状态,则需加0.025mol的氧化铜,质量是0.025mol×80g/mol=2g,
故答案为:1;CuO;2;
(4)再将K1断开,闭合K2,电流计指针发生偏转,形成氢氧燃料电池,通氧气的是正极,该电极上发生得电子的还原反应:O2+4e-+4H+=2H2O,
故答案为:O2+4e-+4H+=2H2O.
点评 本题综合考查学生原电池和电解池的工作原理以及电极反应式的书写和计算知识,属于综合知识的考查,知识的归纳和整理是关键,难度不大.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 5 | B. | 7 | C. | 10 | D. | 11 |
| A. | 溴乙烷 | B. | 溴苯 | ||
| C. | 乙醛 | D. | 高级脂肪酸甘油酯 |
| X | Y | ||
| Z | W | Q |
| A. | 阴离子还原性:W>Q | |
| B. | X的最低价氢化物能形成分子间氢键 | |
| C. | Z能在自然界中以游离态存在 | |
| D. | Na与Y能形成化合物Na2Y2,1 mol Na2Y2与CO2反应,转移电子数为1 NA |
| A. | 原子序数X>Y | B. | 离子半径X>Y | ||
| C. | X和Y一定在同一周期 | D. | X是第IIA族元素,Y是第VIIA族元素 |
| A. | 邻二甲苯 | B. | 均三甲苯 | C. | 异丙醇 | D. | 对苯二酚 |
| A. | NaOH | B. | CO2 | C. | H2O | D. | CaCl2 |