题目内容
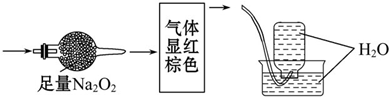
无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,且无气体剩余,则甲气体的组成为( )

| A、NO2、N2 |
| B、NO、CO2 |
| C、NO2、CO2 |
| D、NO、CO2、N2 |
考点:常见气体的检验
专题:物质检验鉴别题
分析:二氧化氮是红棕色的气体,浓硫酸可以和氨气反应,二氧化碳可以和过氧化钠反应生成氢氧化钠和氧气,一氧化氮无色,与氧气立即反应变为红棕色的二氧化氮,氮气不溶于水,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,说明无氮气,据此分析解答.
解答:
解:二氧化氮是红棕色的气体,所以无色混合气体甲中一定不存在二氧化氮;
二氧化碳可以和过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,
一氧化氮无色,与氧气立即反应变为红棕色的二氧化氮,通过足量的过氧化钠后气体显红棕色,说明有NO、CO2,
排水法收集气体,广口瓶被上升的水注满,说明没有N2,
所以甲气体的组成为:NO、CO2;
故选B.
二氧化碳可以和过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,
一氧化氮无色,与氧气立即反应变为红棕色的二氧化氮,通过足量的过氧化钠后气体显红棕色,说明有NO、CO2,
排水法收集气体,广口瓶被上升的水注满,说明没有N2,
所以甲气体的组成为:NO、CO2;
故选B.
点评:本题考查常见气体的检验和性质,把握常见气体的化学性质及气体的溶解性是解题的关键,注意二氧化碳和过氧化钠的反应,题目难度不大.

练习册系列答案
相关题目
将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中的K+、Al3+、SO42-的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取的K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比( )
| A、1:1:1 |
| B、2:1:2 |
| C、1:1:2 |
| D、2:1:1 |
下列微粒半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关电池的说法不正确的是( )
| A、手机上用的锂离子电池属于二次电池 |
| B、锌锰干电池中,锌电极是负极 |
| C、甲醇燃料电池可把化学能转化为电能 |
| D、铜锌原电池电子沿外电路从铜电极流向锌电极 |
往2支分别装有浅绿色的Fe(NO3)2和FeSO4溶液的试管中,逐滴加入稀盐酸时,溶液的颜色变化应该是( )
| A、前者基本没有改变、后者变棕黄色 |
| B、前者变棕黄色、后者也变棕黄色 |
| C、前者变棕黄色、后者基本没有改变 |
| D、前者、后者都基本没有改变 |
X元素最高价氧化物对应的水化物为HnXO2n,则它对应的气态氢化物为( )
| A、H3n-8X |
| B、H3nX |
| C、H8-3nX |
| D、H12-3nX |
下列说法正确的是( )
| A、1mol任何气体所含分子数都相同,体积也都约为22.4 L |
| B、1molKClO3和1molSO2中,所含氧原子的个数比为3:2 |
| C、物质的量就是物质的摩尔质量 |
| D、在非标准状况下,1 mol任何物质的体积都不是22.4 L |
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.下列叙述正确的是( )
| A、X、Y、Z的稳定性逐渐减弱 |
| B、A、B、C、D只有5种原子 |
| C、X、Y、Z三种化合物的还原性逐渐升高 |
| D、自然界中存在多种由A、B、C、D四种元素组成的化合物 |