题目内容
将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中的K+、Al3+、SO42-的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取的K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比( )
| A、1:1:1 |
| B、2:1:2 |
| C、1:1:2 |
| D、2:1:1 |
考点:溶液的组成,物质的量浓度
专题:物质的量浓度和溶解度专题
分析:设混合溶液的体积为VL,K2SO4溶液、Al2(SO4)3溶液、纯水的体积分别为V1、V2、V3,根据K+、Al3+混合前后物质的量相等以及V1+V2+V3=V计算.
解答:
解:设混合溶液的体积为VL,K2SO4溶液、Al2(SO4)3溶液、纯水的体积分别为V1、V2、V3,
根据K+、Al3+混合前后物质的量守恒可得关系式:0.1mol/L×2×V1=0.1mol/L×V,0.2mol/L×2×V2=0.1mol/L×V,
解得:V1=
V,V2=
V,
由V1+V2+V3=V可知,V3=V-V1-V2=V-
V-
V=
V,
因此V1:V2:V3=
V:
V:
V=2:1:1,
故选D.
根据K+、Al3+混合前后物质的量守恒可得关系式:0.1mol/L×2×V1=0.1mol/L×V,0.2mol/L×2×V2=0.1mol/L×V,
解得:V1=
| 1 |
| 2 |
| 1 |
| 4 |
由V1+V2+V3=V可知,V3=V-V1-V2=V-
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
因此V1:V2:V3=
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
故选D.
点评:本题考查了混合溶液离子浓度的大小计算,难度中等,把握好混合前后离子的物质的量想等是解题的关键.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
科学家已经发现一种新型氮分子,其化学式为N4,在相同条件下,等质量的N4和N2相同的是( )
| A、原子数 | B、分子数 |
| C、体积 | D、物质的量 |
有机物 的名称是( )
的名称是( )
 的名称是( )
的名称是( )| A、2-甲基丁烷 |
| B、3-甲基丁烷 |
| C、2-乙基丙烷 |
| D、1,1-二甲基丙烷 |
下列各组中的两种有机化合物,属于同系物的是( )
| A、2-甲基丁烷和丁烷 |
| B、新戊烷和2,2-二甲基丙烷 |
| C、间二甲苯和乙苯 |
| D、1-己烯和环己烷 |
下列说法正确的是( )
| A、凡是卤代烃一定能够发生消去反应 |
| B、卤代烃在碱性溶液中的水解反应属于取代反应 |
| C、苯酚显弱酸性,其溶液可使石蕊试液变红色 |
| D、正丁烷的沸点比异丁烷低 |
下列电子式正确的是( )
A、 |
B、 |
C、 |
D、 |
下列离子方程式中,正确的是( )
| A、在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| B、在硝酸银溶液中滴入氯化钠溶液:Ag++Cl-=AgCl↓ |
| C、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| D、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
下列化合物中,含有非极性共价键的离子化合物是( )
| A、CaC2 |
| B、N2H4 |
| C、Na2S |
| D、NH4NO3 |
无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,且无气体剩余,则甲气体的组成为( )
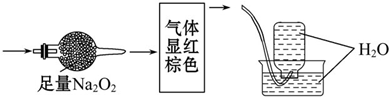

| A、NO2、N2 |
| B、NO、CO2 |
| C、NO2、CO2 |
| D、NO、CO2、N2 |