题目内容
下列微粒半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:A.电子层越多离子半径越大;
B.同主族自上而下原子半径增大;
C.同周期元素的原子半径从左向右在减小;
D.同种元素的阴离子半径大于其原子半径.
B.同主族自上而下原子半径增大;
C.同周期元素的原子半径从左向右在减小;
D.同种元素的阴离子半径大于其原子半径.
解答:
解:A.K+比Na+多一个电子层,则离子半径K+>Na+,故
>1,故A正确;
B.Be、Mg同主族,自上而下原子半径增大,故原子半径Mg>Be,则
<1,故B错误;
C.Si、P同周期,原子半径从左向右逐渐减小,故
<1,故C错误,
D.同种元素的阴离子半径大于其原子半径,则
<1,故D错误,
故选A.
| r(K+) |
| r(Na+) |
B.Be、Mg同主族,自上而下原子半径增大,故原子半径Mg>Be,则
| r(Be) |
| r(Mg) |
C.Si、P同周期,原子半径从左向右逐渐减小,故
| r(P) |
| r(Si) |
D.同种元素的阴离子半径大于其原子半径,则
| r(Cl) |
| r(Cl-) |
故选A.
点评:本题考查微粒半径的比较,明确原子半径比较、离子半径与原子半径的关系即可解答,题目难度不大.

练习册系列答案
相关题目
有机物 的名称是( )
的名称是( )
 的名称是( )
的名称是( )| A、2-甲基丁烷 |
| B、3-甲基丁烷 |
| C、2-乙基丙烷 |
| D、1,1-二甲基丙烷 |
下列离子方程式中,正确的是( )
| A、在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| B、在硝酸银溶液中滴入氯化钠溶液:Ag++Cl-=AgCl↓ |
| C、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| D、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
下列化合物中,含有非极性共价键的离子化合物是( )
| A、CaC2 |
| B、N2H4 |
| C、Na2S |
| D、NH4NO3 |
下列说法中不正确的是( )
| A、化石燃料在任何条件下都能充分燃烧 |
| B、化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 |
| C、直接燃烧煤不如将煤进行深加工后,再燃烧效果好 |
| D、固体煤变为气体燃料后,燃烧效率将更高 |
金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性.关于钠的叙述中,正确的是( )
| A、钠是银白色金属,熔点低,硬度大 |
| B、钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠 |
| C、加热时,金属钠剧烈燃烧,产生黄色火焰 |
| D、金属钠着火可以用泡沫灭火器或用干燥的沙土灭火 |
下列叙述正确的是( )
| A、强酸溶液中的氢离子浓度一定大于弱酸溶液中的氢离子浓度 |
| B、NaOH溶液的导电性一定比氨水的导电性强 |
| C、不溶性盐都是弱电解质,可溶性酸都是强电解质 |
| D、二氧化硫和乙醇均属共价化合物,是非电解质 |
无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,且无气体剩余,则甲气体的组成为( )
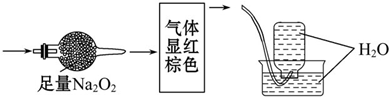

| A、NO2、N2 |
| B、NO、CO2 |
| C、NO2、CO2 |
| D、NO、CO2、N2 |