题目内容
15.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O下列各组实验中最先出现浑浊的是( )| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0.2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
分析 表中给出的数据为浓度和温度的影响,一般来说,浓度越大,温度越高,反应速率越大,以此解答该题.
解答 解:对于该反应来说浓度越大,温度越高,反应速率越大,表中C、D温度较高,则应大于A、B的反应速率,C、D相比较,D的浓度较大,则反应速率较大.
故选D.
点评 本题考查化学反应速率,为高考高频考点,侧重于反应速率的影响因素的考查以及数据处理能力,能较好的培养学生良好的科学素养,难度不大,学习中注意掌握影响化学反应速率的因素.

练习册系列答案
相关题目
5.对于药品的使用和作用下列说法不正确的是( )
| A. | 毒品就是有毒的药品 | |
| B. | 我国明代医学家李时珍所著的医学名著是《本草纲目》 | |
| C. | R表示处方药,OTC表示非处方药 | |
| D. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 |
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 在标准状况下,22.4 L CH4与NH3的混合气体所含的电子数为10NA | |
| C. | 标准状况下,224 mL水含有的电子数为0.1 NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
10.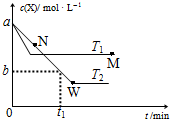 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•L--1•min--1 | |
| C. | M点时再加入一定量X,平衡后X的转化率减小 | |
| D. | 该反应进行到M点放出的热量小于进行到W点放出的热量 |
20.向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色透明溶液.下列对此现象的相关说法不正确的是( )
| A. | 沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+ | |
| B. | 向反应后的溶液中加入乙醇,有沉淀析出 | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对 | |
| D. | 反应前后,Cu2+浓度不变 |
7.下列叙述正确的是( )
| A. | 反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,可以设计成原电池 | |
| B. | Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率 | |
| C. | 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化 | |
| D. | Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动 |
4.根据如图所示的信息,判断下列叙述不正确的是( )
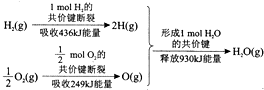

| A. | 1molH2(g)的共价键形成放出436kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1molH2(g)跟$\frac{1}{2}$molO2(g)反应生成1molH2O(g)释放能量245kJ | |
| D. | 1molH2(g)与$\frac{1}{2}$molO2(g)的总能量大于1molH2O(g)的能量 |
 .
.