题目内容
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 在标准状况下,22.4 L CH4与NH3的混合气体所含的电子数为10NA | |
| C. | 标准状况下,224 mL水含有的电子数为0.1 NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
分析 A、氮气和CO的摩尔质量均为28g/mol;
B、求出混合物的物质的量,然后根据甲烷和氨气均含10个电子来分析;
C、标况下水为液态;
D、二氧化硫和氧气的反应为可逆反应.
解答 解:A、氮气和CO的摩尔质量均为28g/mol,故等质量的氮气和CO的物质的量相等,但不一定是NA个,故A错误;
B、标况下22.4L混合物的物质的量为1mol,而甲烷和氨气均含10个电子,故1mol混合物中含10NA个电子,故B正确;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和含有的电子数,故C错误;
D、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故转移的电子数小于2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
13.提出原子核式结构模型的科学家是( )
| A. | 汤姆生 | B. | 玻尔 | C. | 卢瑟福 | D. | 查德成克 |
14.实验室中用CuSO4•5H2O来配制100mL 0.1mol/L CuSO4溶液,需要称量CuSO4•5H2O的质量为( )
| A. | 1.6 g | B. | 2.0 g | C. | 0.01 mol | D. | 2.5 g |
11.据报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点.假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是( )
| A. | 硅是一种洁净的能源,其燃烧产物SiO2粉尘对环境无污染 | |
| B. | Si在空气中完全燃烧放出的热量多 | |
| C. | 自然界硅的蕴藏量很丰富 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 |
18.下列物质在常温常压下为液体的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 葡萄糖 |
15.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O下列各组实验中最先出现浑浊的是( )
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0.2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
13.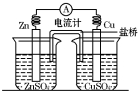 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )| A. | 构成原电池,锌片作正极 | |
| B. | 铜片附近Cu2+离子浓度减小 | |
| C. | 锌片上有铜析出,铜片上没有 | |
| D. | 导线中电流的方向是由锌片流向铜片 |
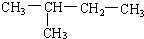 (8)
(8)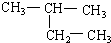 (9)CH2=CH-CH3
(9)CH2=CH-CH3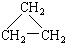 (11)2,2-二甲基丁烷.
(11)2,2-二甲基丁烷.