题目内容
5.由锌片、铜片和200mL稀硫酸组成的原电池,若锌片只发生原电池反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好消耗一半,则产生这些气体时,共消耗锌的质量为4.875g.有0.15NA个电子通过了导线,原稀硫酸中溶质的物质的量浓度为0.75mol/L(设溶液体积不变)分析 原电池时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为原电池正极,发生还原反应,电极方程式为2H++2e-═H2↑,根据转移电子相等计算消耗m(Zn),根据氢气和转移电子之间的关系式计算转移电子数,根据H原子守恒计算硫酸浓度.
解答 解:原电池时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为原电池正极,发生还原反应,电极方程式为2H++2e-═H2↑,n(H2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,
根据转移电子相等得n(Zn)=$\frac{0.075mol×2}{2}$=0.075mol,m(Zn)=0.075mol×65g/mol=4.875g;
根据氢气和转移电子之间的关系式知,转移电子个数=0.075mol×2×NA/mol=0.15NA,
参加反应的硫酸n(H2SO4)=n(H2)=0.075mol,占原来硫酸的一半,则原来硫酸的物质的量为0.075mol×2=0.15mol,
所以原硫酸的物质的量浓度=$\frac{n}{V}$=$\frac{0.15mol}{0.2L}$=0.75mol/L,
故答案为:4.875;0.15NA;0.75mol/L.
点评 本题以原电池原理为载体考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间关系是解本题关键,注意原子守恒、转移电子守恒的灵活运用.

练习册系列答案
相关题目
15.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O下列各组实验中最先出现浑浊的是( )
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0.2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
16.下列有关说法正确的是( ) 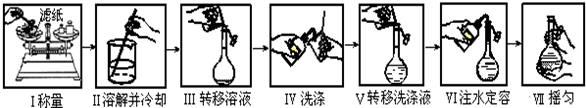

| A. | 如图是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步 | |
| B. | 苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 | |
| C. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 | |
| D. | 在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
13.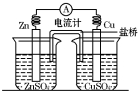 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )| A. | 构成原电池,锌片作正极 | |
| B. | 铜片附近Cu2+离子浓度减小 | |
| C. | 锌片上有铜析出,铜片上没有 | |
| D. | 导线中电流的方向是由锌片流向铜片 |
8.水溶液X中只可能溶有Na+、K+、Mg2+、Al3-、AlO2-、SiO32-、HCO3-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图所示实验:
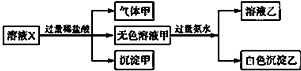
下列判断正确的是( )

下列判断正确的是( )
| A. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| B. | HCO3-和SO42-一定不存在于溶液X中 | |
| C. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| D. | 溶液中一定存在大量CO32- |
6.阿伏伽德罗常数用NA表示,则下列叙述中正确的是( )
| A. | 0.1 mol Na2O2中所含的阴离子数为0.2NA | |
| B. | 常温常压下,5.6 g N2和CO混合物中所含有的原子总数为0.4 NA | |
| C. | 标准状况下,2.24 L H2O中含有的氧原子数目为0.1 NA | |
| D. | Cu和足量的浓硫酸反应产生4.48 L气体时,转移的电子数为0.4 NA |
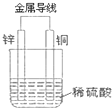 (1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑
(1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑