题目内容
6.两种非金属元素X和Y,能分别形成常见气态氢化物Q和P,Q和P都是无色刺激性气味的气体,且都极易溶于水.常温常压下,Q的密度与空气的密度之比为0.59:1.标准状况下,P的密度为1.63g/L.Q与P能1:1化合生成盐M.(1)元素X在周期表中的位置为第二周期ⅤA族,M的电子式为
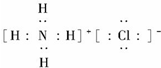 .
.(2)氢化物Q极易溶于水的主要原因是液氨分子与水分子间存在氢键.
(3)X元素与氢元素组成分子式为HX3的化合物,该化合物能与Q以1:1化合生成盐W,盐W中阴离子的结构与CO2相似,写出该阴离子的结构式:[N═N═N]-.
(4)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,在水中是一种缓释强效消毒剂,请用化学方程式表示其原因:NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O.
(5)某化合物由硼元素与X元素组成,化学式为BX,有多种结晶形态,其中立方结晶被认为是目前已知最硬的物质,BX立方结晶高硬度的原因是BN的立方结晶属于原子晶体,B、N以共价键结合形成空间网状结构.
分析 Q的密度与空气的密度之比为0.59:1,所以Q的相对分子量为0.59×29=17,所以Q是氨气,标准状况下,P的密度为1.63g/L,所以P的相对分子质量为:1.63g/L×22.4L/mol=37,所以气态氢化物P是HCl,Q与P能1:1化合生成盐M是氯化铵,所以X是氮、Y是氯元素,由此分析解答.
解答 解:Q的密度与空气的密度之比为0.59:1,所以Q的相对分子量为0.59×29=17,所以Q是氨气,标准状况下,P的密度为1.63g/L,所以P的相对分子质量为:1.63g/L×22.4L/mol=37,所以气态氢化物P是HCl,Q与P能1:1化合生成盐M是氯化铵,所以X是氮、Y是氯元素,
(1)元素氮质子数是7,两个电子层,最外层5个电子,所以在周期表中的位置为第二周期ⅤA族,氯化铵的电子式为: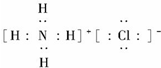 ,故答案为:第二周期ⅤA族;
,故答案为:第二周期ⅤA族;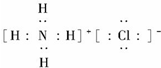 ;
;
(2)氢化物Q是氨气,氨分子极易溶于水的主要原因是液氨分子与水分子间存在氢键,故答案为:液氨分子与水分子间存在氢键;
(3)HN3的化合物,该化合物能与Q以1:1化合生成盐是NH4N3,阴离子为:N3-,结构与CO2相似,所以结构式为:[N═N═N]-,故答案为:[N═N═N]-;
(4)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,即为:NH2Cl,与水发生水解反应,方程式为:NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O,
故答案为:NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O;
(5)BN立方结晶被认为是目前已知最硬的物质,是因为B、N以共价键结合形成空间网状结构,故答案为:BN的立方结晶属于原子晶体,B、N以共价键结合形成空间网状结构.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素名称为解答关键,注意掌握等电子体结构相似,同时明确常见化学用语的概念及表示方法.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | NO任意排放会造成大气污染 | |
| B. | 汽车尾气、制硝酸工厂的废气均含NO | |
| C. | NO是造成光化学烟雾的唯一直接原因 | |
| D. | NO分子所含电子总数为奇数 |
| A. | 1.6 g | B. | 2.0 g | C. | 0.01 mol | D. | 2.5 g |
| A. | Zn片作正极,Zn被还原 | B. | Zn片作负极,Zn被氧化 | ||
| C. | 碳棒作正极,O2被还原 | D. | 碳棒作负极,O2被氧化 |
| A. | 硅是一种洁净的能源,其燃烧产物SiO2粉尘对环境无污染 | |
| B. | Si在空气中完全燃烧放出的热量多 | |
| C. | 自然界硅的蕴藏量很丰富 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 |
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 葡萄糖 |
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0.2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
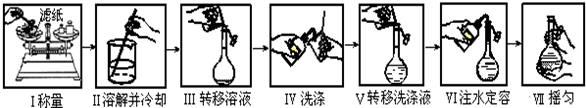
| A. | 如图是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步 | |
| B. | 苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 | |
| C. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 | |
| D. | 在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
 .
. ,合成路线流程图为:
,合成路线流程图为: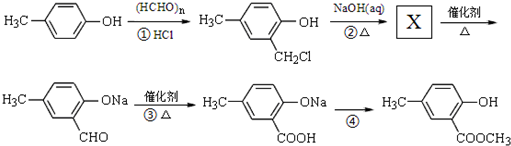
 ;
; 任意一种.
任意一种.