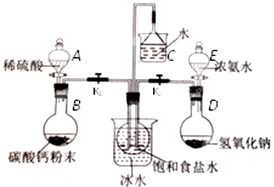
题目内容
1.联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图: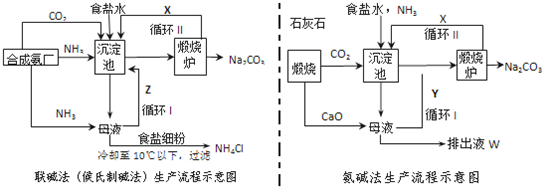
(1)沉淀池中发生反应的化学方程式为NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(2)X是CO2,Y是NH3(填化学式);
(3)从理论上分析,在氨碱法生产过程中不需要(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为CaCO3+2NaCl═Na2CO3+CaCl2;
(4)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是b;
a.常温时氯化铵的溶解度比氯化钠小 b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(5)相比于氨碱法,指出联碱法的一项优点不产生无用的CaCl2(或提高了食盐的转化率,或原料利用率高等).
分析 (1)依据生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙与铵盐反应生成的氨气;
(3)氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
(4)a、常温时氯化铵的溶解度比氯化钠大;
b、向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度;
c、加入食盐细粉目的是提高Cl-的浓度,使氯化氨析出;
(5)综合分析两个过程的流程图和生成产物,及过程中循环利用的特征分析判断.
解答 解:(1)依据流程图分析可知,生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,故答案为:CO2;NH3;
(3)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;反应过程为NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,故答案为:不需要;CaCO3+2NaCl═Na2CO3+CaCl2;
(4)联碱法中从母液中提取氯化铵晶体的过程中;
a、常温时氯化铵的溶解度比氯化钠大,故a错误;
b、通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c、加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;
故答案为:b;
(5)从两个过程需要的原理和循环利用分析氨价法循环利用氨气时加入的氧化钙在反应过程中 会最终生成无用的氯化钙,联碱法反应过程中最终生成氯化铵可以做氮肥;故答案为:不产生无用的CaCl2(或提高了食盐的转化率,或原料利用率高等).
点评 本题考查了联碱法和氨碱法生产流程的原理比较和物质分析判断,纯碱制备的条件应用和服产物的提纯析出,反应过程中反应的原理分析和物质来源是解题的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案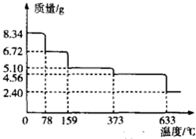 铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:
铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:(1)在FeCl3饱和溶液中滴加饱和纯碱溶液可观察到有红褐色沉淀和气泡生成,写出该反应的离子方程式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(2)工业上应用铁矿石冶炼金属铁时涉及的反应有:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47.2kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+640.5kJ•mol-1
写出CO还原FeO的热化学方程式:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
(3)绿矾(FeSO4•7H2O)在受热条件下不稳定,易发生分解.现取绿矾样品8.34g,在隔绝空气的条件下加热,样品质量随着温度的变化曲线如图所示.
159℃时的固体物质的化学式为FeSO4•H2O;633℃时分解除生成固体物质外,还有两种气体物质,且这两种气体物质的密度之比为4:5,则633℃时分解的化学方程式为2FeSO4$\frac{\underline{\;633℃\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(4)已知密闭容器中发生反应:Fe(S)+CO2(g)?FeO(s)+CO(g)△H>0.测得在不同温度下,该反应的平衡常数随温度的变化数据如表所示.
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
a.1.47、2.40 b.2.40、1.47 c.0.64、0.48d.0.48、0.64
②500℃时,在容积为2L的密闭容器中放入2mol铁粉和2mol CO2,若测得10min时反应达到平衡状态,则0~10min内的平均反应速率v(CO2)=0.05mol/(L•min).
③800℃时,在反应达到平衡状态后,要使反应速率减小且平衡逆向移动,可采取的措施有减小二氧化碳的物质的量(或者降低温度)(写出一种即可).
(5)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌和病毒,在对水的消毒和净化过程中,不产生任何对人体有害的物质,其消毒和除污效果比含氯消毒剂要好.高铁酸钠的制备方法之一是电解:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,电解质溶液选用NaOH溶液.该电解池的阳极反应式为Fe+8OH--6e-=FeO42-+4H2O.
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |
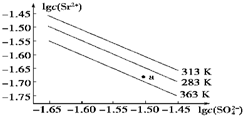
| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |

| A. | M中达到平衡后再通入一定量的氦气,平衡不移动,容器内气体的密度不变 | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | N中达到平衡后再通入一定量的氦气时,v(正)<v(逆) |
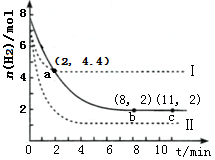 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 从反应开始至a 点,ν(CO2)=0.9 mol•L-1•min-1 | |
| B. | 曲线Ⅰ对应的条件改变可能是减小压强 | |
| C. | 曲线Ⅱ对应的条件改变可能是充入氢气 | |
| D. | 该温度下,此反应的化学平衡常数的数值为0.5 |