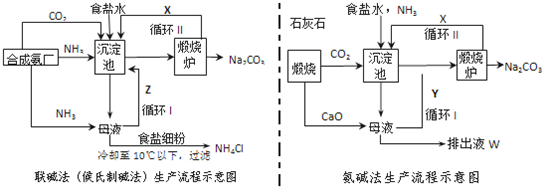
题目内容
10.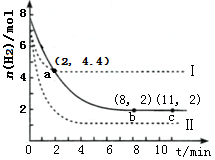 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 从反应开始至a 点,ν(CO2)=0.9 mol•L-1•min-1 | |
| B. | 曲线Ⅰ对应的条件改变可能是减小压强 | |
| C. | 曲线Ⅱ对应的条件改变可能是充入氢气 | |
| D. | 该温度下,此反应的化学平衡常数的数值为0.5 |
分析 A.由图可知,a点氢气的物质的量为4.4mol,参加反应的氢气的物质的量为8mol-4.4mol=3.6mol,氢气的浓度变化量为$\frac{3.6mol}{2L}$=1.8mol/L,根据v=$\frac{△c}{△t}$计算v(H2),利用速率之比等于化学计量数之比计算v(CO2);
B.由图可知,曲线Ⅰ到达平衡的时间缩短,反应速率加快,平衡时氢气的物质的量增大,平衡向逆反应移动;
C.条件改变如果是充入氦气,体积一定各组成份的浓度不变,平衡不移动,反应速率不变;
D.由图可知,T℃时平衡时氢气的物质的量为2mol,参加反应的氢气的物质的量为8mol-2mol=6mol,氢气的浓度变化量为3mol/L,结合三段式计算平衡时各组分的平衡浓度,以此计算平衡常数.
解答 解:A.由图可知,a点氢气的物质的量为4.4mol,参加反应的氢气的物质的量为8mol-4.4mol=3.6mol,氢气的浓度变化量为$\frac{3.6mol}{2L}$=1.8mol/L,故v(H2)=$\frac{1.8mol/L}{2min}$=0.9mol•L-1•min-1,速率之比等于化学计量数之比,故v(CO2)=$\frac{1}{3}$v(H2)=0.3mol•L-1•min-1,故A错误;
B.由图可知,曲线Ⅰ到达平衡的时间缩短,反应速率加快,平衡时氢气的物质的量增大,平衡向逆反应移动,正反应放热反应,说明是升高温度,故B错误;
C.条件改变如果是充入氦气,体积一定各组成份的浓度不变,平衡不移动,反应速率不变,而曲线Ⅱ速率加快,氢气的量变少,平衡移动,故C错误;
D.由图可知,T℃时平衡时氢气的物质的量为2mol,参加反应的氢气的物质的量为8mol-2mol=6mol,氢气的浓度变化量为3mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):3 4 0 0
变化(mol/L):1 3 1 1
平衡(mol/L):2 1 1 1
故该温度下平衡常数K=$\frac{1×1}{2×{1}^{3}}$=0.5,故D正确;
故选D.
点评 本题考查物质的量随时间变化曲线,为高频考点,把握图中物质的量的变化、平衡移动、平衡常数K的计算为解答的关键,侧重分析与应用能力的考查,注意利用平衡浓度计算K,题目难度不大.

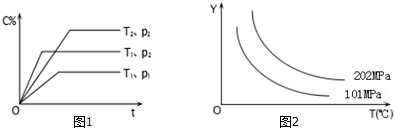
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的质量分数 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气中C的体积分数 |
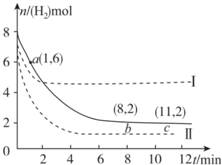
| A. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| B. | 曲线II对应的条件改变是降低压强 | |
| C. | 反应开始至a点时v(H2)=1mol•L-1•min-1 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<$\frac{8}{3}$mol•L-1 |
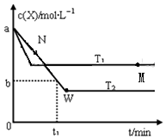 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点时再加入一定量的X,平衡后X的转化率增大 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol/(L•min) | |
| C. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点吸收的热量小于进行到W点放出的热量 |
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
①太阳能 ②天然气 ③地热能 ④煤 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能.
| A. | ①②③⑦⑧ | B. | ①③⑤⑦⑧ | C. | ①③⑤⑧ | D. | ②④⑤⑥⑦ |
| A. | 常温常压下,18g重水(D2O)所含的中子数为10NA | |
| B. | 100℃时,1LpH=1的硫酸溶液中,含有0.2NA个H+ | |
| C. | 71g氯气发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,14gN2和CO的混合气体中含有的原子数目为NA |