题目内容
14.实验需要0.10mol/L NaOH溶液470mL,根据溶液配制中情况回答下列问题:(1)配制该溶液应选用500mL 容量瓶.
(2)根据计算得知,所需NaOH的质量为2.0 g.
(3)定容时,若加入的水超过刻度线,必须采取的措施是:重新配制.
(4)下列操作对所配浓度有何影响(填写字母)偏低的有B; 无影响的有A.
A.容量瓶未干燥即用来配制溶液;
B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.定容时俯视刻度线.
分析 (1)配制470mL溶液,需要选用500mL容量瓶;
(2)根据n=cV计算出500mL 0.10mol/LNaOH溶液中含有的氢氧化钠的物质的量,再根据m=nM计算出需要氢氧化钠的质量;
(3)定容时,若加入的水超过刻度线,会导致配制的溶液浓度偏小,此次配制失败,需要重新配置;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:(1)实验室没有470mL容量瓶,需要选用500mL容量瓶,
故答案为:500;
(2)500mL 0.10mol/LNaOH溶液中含有氢氧化钠的物质的量为:0.1mol/L×0.5L=0.05mol,需要氢氧化钠的质量为:40g/mol×0.05mol=2.0g,
故答案为:2.0;
(3)配制过程中,定容时若加入的水超过刻度线,此次配制失败,需要倒掉重新配制,
故答案为:重新配制;
(4)A、容量瓶未干燥即用来配制溶液,配制的溶液浓度无影响;
B、将NaOH放在纸张上称量,导致氢氧化钠潮解,配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,冷却后溶液体积偏小,配制的溶液浓度偏高;
D、定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
故答案为:B;A.
点评 本题考查了配制一定物质的量浓度的溶液,题目难度中等,要求学生掌握配制一定物质的量浓度溶液的正确操作方法,本题难点在于误差分析,注意掌握误差分析方法与技巧.

练习册系列答案
相关题目
4.V L Al2(SO4)3溶液中含有Al3+m g,则溶液中SO42-的物质的量浓度为( )
| A. | $\frac{27m}{v}$mol/L | B. | $\frac{m}{9v}$mol/L | C. | $\frac{m}{27v}$mol/L | D. | $\frac{m}{18v}$mol/L |
2.下列说法中正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 金属氧化物一定不能与碱发生反应 |
9.下列说法正确的是( )
| A. | NaCl溶液在电流作用下电离成Na+ 和Cl- | |
| B. | 蔗糖在水溶液里或熔融状态时均不导电,所以它不是电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
19.将Na、Fe、Al各0.03mol分别放入100mL 0.1mol•L-1的盐酸中,同温同压下产生气体的体积比为( )
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
20.在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合图1所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图2中,Y轴是指:( )
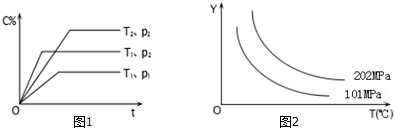

| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的质量分数 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气中C的体积分数 |