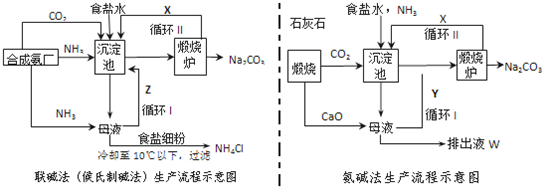
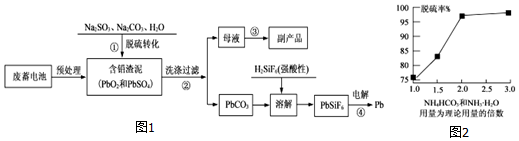
题目内容
11.现有以下物质:①NaOH溶液 ②液氨 ③BaCO3固体 ④熔融KHSO4⑤碘化银与水混合形成的黄色透明液体 ⑥铜 ⑦CO2⑧CH3COOH(1)以上物质中属于非电解质的是②⑦(填序号)以上纯净物中能导电的是④⑥(填序号)
(2)写出签别⑤的操作方法用一束强光照射黄色透明液体,从侧面可看到一条光亮的通路.
(3)写出①和⑧的水溶液反应的离子方程式CH3COOH+OH-=CH3COO-+H2O.
(4)写出④的电离方程式KHSO4=K++HSO4-.
(5)在足量④的水溶液中加入少量③,发生反应的离子方程式为BaCO3+2H++SO42-═+BaSO4+H2O+CO2↑.
分析 (1)非电解质是在水溶液里或熔融状态下都不能导电的化合物,前提必须是化合物;纯净物中存在自由移动的带电荷粒子时能够导电;
(2)根据胶体具有丁达尔效应分析;
(3)反应生成醋酸钠和水,醋酸和水在离子反应中应保留化学式;
(4)硫酸氢钾电离生成钾离子和硫酸氢根;
(5)碳酸钡能与硫酸氢钾反应生成硫酸钡和二氧化碳等.
解答 解:(1)②液氨⑦CO2在水溶液里或熔融状态下都不能导电,是非电解质;以上物质中属于纯净物的有:②液氨 ③BaCO3固体 ④熔融KHSO4 ⑥铜 ⑦CO2⑧CH3COOH,存在自由移动粒子的有④⑥,
故答案为:②⑦;④⑥;
(2)⑤碘化银与水混合形成的黄色透明液体为胶体,可以利用丁达尔效应鉴别,操作方法为:用一束强光照射黄色透明液体,从侧面可看到一条光亮的通路,
故答案为:用一束强光照射黄色透明液体,从侧面可看到一条光亮的通路;
(3)醋酸(CH3COOH)和氢氧化钠溶液反应生成醋酸钠和水,该离子反应为:CH3COOH+OH-=CH3COO-+H2O,
故答案为:CH3COOH+OH-=CH3COO-+H2O;
(4)硫酸氢钾电离生成钾离子和硫酸氢根,电离方程式为:KHSO4=K++HSO4-,
故答案为:KHSO4=K++HSO4-;
(5)碳酸钡能与硫酸氢钾反应生成硫酸钡和二氧化碳等,反应的离子方程式为:BaCO3+2H++SO42-═+BaSO4+2H2O+CO2↑,
故答案为:BaCO3+2H++SO42-═+BaSO4+H2O+CO2↑.
点评 本题考查较为综合,涉及离子方程式书写、电解质与非电解质判断、胶体性质等知识,题目难度中等,明确常见元素及其化合物性质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于新能源的是( )
①太阳能 ②天然气 ③地热能 ④煤 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能.
①太阳能 ②天然气 ③地热能 ④煤 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能.
| A. | ①②③⑦⑧ | B. | ①③⑤⑦⑧ | C. | ①③⑤⑧ | D. | ②④⑤⑥⑦ |
19.设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温常压下,18g重水(D2O)所含的中子数为10NA | |
| B. | 100℃时,1LpH=1的硫酸溶液中,含有0.2NA个H+ | |
| C. | 71g氯气发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,14gN2和CO的混合气体中含有的原子数目为NA |
16.下列叙述正确的是( )
| A. | 硫离子的结构示意图为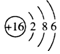 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
3.从2mol/L的NaOH溶液中取出100mL,下列关于这100mL溶液的叙述中错误的是( )
| A. | 含NaOH 0.2mol | B. | 浓度2mol/L | ||
| C. | 含NaOH 4g | D. | 溶质的质量分数与原溶液相同 |