��Ŀ����
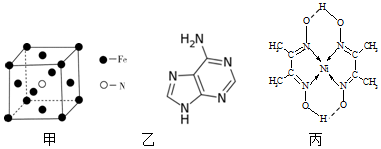
20��ij��ѧ�о�С��������ͼװ��̽��FeSO4�ֽ��IJ��
�������ϵ�֪��SO3����ˮ���γɴ�������������ҵ��ͨ����Ũ������ΪSO3���ռ���
ʵ�鲽�裺��ͼ��װ����������ʡ�Լг������������װ�õ������ԣ�ȷ��ȡm g FeSO4��������Ӳ�ʲ������У���E�еĵ��ܳ���ˮ�ۣ�����K��ͨ��һ��ʱ���N2���رջ���K������A�еIJ�����һ��ʱ���E�е�������ˮ�ۼ���ƿ���ռ����������壬�ô����ǵ�ľ������E�����ռ������壬�����ǵ�ľ���ܹ���ȼ����A�й��岻�ٷֽ��ֹͣ���ȣ���K������ͨ�뵪������������ȴ���õ�����ɫ��ĩ����ش��������⣺
��1��B��Ũ��������������շֽ������SO3��
��2��ʵ��ǰͨ��һ��ʱ��N2��Ŀ�����ž�װ���еĿ�����FeSO4��ȫ�ֽ����Ҫͨ��һ��ʱ��N2��ԭ���ǽ�װ���ڲ�����������������װ�ã�ʹ����ȫ�����գ�
��3��ʵ������з���C����Һ��ɫ��dz��D�������Ա仯��д��C�з�����Ӧ�����ӷ���ʽ5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+��
| ʵ�� | �ζ��� ��ʼ���� | �ζ� �յ���� |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
I������Bװ����ʵ��ǰ������0.80g��
II����ʵ���C�е���Һȫ��ת����100mL����ƿ�У�����ˮϡ�����̶��ߣ�
III��ȷ��ȡ20.00mL��Һ����ƿ�У���������ϡ�����ữ����0.20mol/L��H2C2O4��Һ�ζ����յ㣻
IV���ظ�ʵ��3�Σ���¼�������
�ٵζ����յ��������Һ���Ϻ�ɫ��Ϊ��ɫ�Ұ���Ӳ��ָ����Ϻ�ɫ��
��FeSO4�ֽ�Ļ�ѧ����ʽΪ8FeSO4$\frac{\underline{\;����\;}}{\;}$4Fe2O3+2SO3��+6SO2��+O2����
��5�������һ��ʵ��������A�е�FeSO4�Ƿ���ȫ�ֽ⽫��Һ��Ĺ���ת�Ƶ�С�ձ��У���������ˮ������ˣ�ȡ������Һ���Թ��У����뼸��K3[Fe��CN��6]��Һ��������������ɫ������˵����������δȫ���ֽ⣬��֮��ֽ���ȫ��
���� ��ͼ��װ����������ʡ�Լг������������װ�õ������ԣ�ȷ��ȡm gFeSO4��������Ӳ�ʲ������У���E�еĵ��ܳ���ˮ�ۣ�����K��ͨ��һ��ʱ���N2���رջ���K������A�еIJ�����һ��ʱ���E�е�������ˮ�ۼ���ƿ���ռ����������壬�ô����ǵ�ľ������E�����ռ������壬�����ǵ�ľ���ܹ���ȼ��֤��������������A�й��岻�ٷֽ��ֹͣ���ȣ���K������ͨ�뵪������������ȴ���õ�����ɫ��ĩ˵���ֽ����������������������Ԫ�ػ��ϼ�һ���н��͵�����SO2������ԭ���غ�͵����غ�����ж����ɲ����л�Ӧ����������������ͨ��װ��B��Ũ����������������װ��C�и��������Һ���ն�������װ��D��Ʒ����Һ����֤���������Ƿ������װ�ã����װ��E�ռ��زĵ��������м��飬
��1��B��Ũ������������շֽ������SO3��
��2��װ���ڿ�����Ӱ��ⶨ�������Ҫͨ�뵪���ž�������ͨ��һ��ʱ��N2��ԭ���ǽ�װ���ڲ�����������������װ����ȫ���գ�
��3��ʵ������з���C����Һ��ɫ��dz��D�������Ա仯˵�������������������Һȫ�����շ���������ԭ��Ӧ��
��4���ٸ��������Һ���Ϻ�ɫ��������ᷢ��������ԭ��Ӧ����Ӧ�յ�������ݸ��������Һ��ɫ�жϣ�
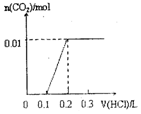
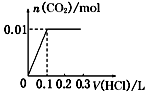
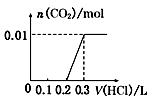
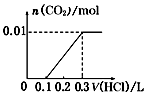
3��ʵ���������ϴ���ȥ������1��2��������Һ���=$\frac{19.98+20.12-0.1}{2}$=20ml��n��H2C2O4��=0.20mol/L��0.020L=0.004mol��
2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O
2 5
n 0.040mol
n=0.0016mol��
װ��C�й���ʣ�����������ʵ���=0.0016mol��$\frac{100}{20}$=0.008mol�����������Ӧ�ĸ���������ʵ���=0.020L��1.00mol/L-0.008mol=0.012mol��
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+��
5 2
n��SO2�� 0.012mol
n��SO2��=0.03mol
����Bװ����ʵ��ǰ������0.80gΪ��������n��SO3��=$\frac{0.80g}{80g/mol}$=0.01mol
��Ԫ�ؽ������ɶ����������ת��0.03mol��2=0.06mol��
ԭ���غ�õ���Ӧ��FeSO4��0.03mol+0.01mol=0.04mol��
2FeSO4 ��Fe2O3��2e-
2 1 2
0.04mol 0.02mol 0.04mol
FeSO4��O2��4e-
1 4
0.005mol 0.02mol
��Ӧ��FeSO4��Fe2O3��SO3��SO2��O2=0.04��0.002��0.01��0.012��0.005=8��4��2��6��1��
�ݴ���д��ѧ����ʽ��
��5������������Ƿ���δ�ֽ���������������ʵ�����ʣ��������Ƿ��������ӣ����뼸��K3[Fe��CN��6]��Һ��������������ɫ����֤�����������ӣ�
��� �⣺��1��̽��FeSO4�ֽ��IJ������ݷ�����֪���ֽ�����������������������ɣ����������ԭ��Ӧ��Ԫ�ء���Ԫ�ػ��ϼ����ߣ�����Ԫ�ػ��ϼ۽������ɶ�������ԭ���غ�ɵõ�ͬʱ������������������B��Ũ������������շֽ������SO3��
�ʴ�Ϊ�����շֽ������SO3��
��2��ʵ��ǰͨ��һ��ʱ��N2��Ŀ�����ž�װ���еĿ�����FeSO4��ȫ�ֽ����Ҫͨ��һ��ʱ��N2��ԭ���ǣ���װ���ڲ�����������������װ�ã�ʹ����ȫ�����գ�
�ʴ�Ϊ���ž�װ���еĿ�������װ���ڲ�����������������װ�ã�ʹ����ȫ�����գ�
��3��ʵ������з���C����Һ��ɫ��dz��D�������Ա仯˵�������������������Һȫ�����գ���Ӧ�����ӷ���ʽΪ��5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+��
�ʴ�Ϊ��5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+��
��4��ȷ��ȡ20.00mL��Һ����ƿ�У���������ϡ�����ữ����0.20mol/L��H2C2O4��Һ�ζ����յ㣬�ǵζ�װ��C��ʣ�������أ�
�ٸ��������Һ���Ϻ�ɫ��������ᷢ��������ԭ��Ӧ����Ӧ�յ�������ݸ��������Һ��ɫ�жϣ��������һ����Һ�Ϻ�ɫ�仯Ϊ��ɫ�Ұ�����ޱ仯֤����Ӧ�ﵽ�յ㣬
�ʴ�Ϊ����Һ���Ϻ�ɫ��Ϊ��ɫ�Ұ���Ӳ��ָ����Ϻ�ɫ��
��3��ʵ���������ϴ���ȥ������1��2��������Һ���=$\frac{19.98+20.12-0.1}{2}$=20ml��n��H2C2O4��=0.20mol/L��0.020L=0.004mol��
2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O
2 5
n 0.040mol
n=0.0016mol��
װ��C�й���ʣ�����������ʵ���=0.0016mol��$\frac{100}{20}$=0.008mol�����������Ӧ�ĸ���������ʵ���=0.020L��1.00mol/L-0.008mol=0.012mol��
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+��
5 2
n��SO2�� 0.012mol
n��SO2��=0.03mol
����Bװ����ʵ��ǰ������0.80gΪ��������n��SO3��=$\frac{0.80g}{80g/mol}$=0.01mol
��Ԫ�ؽ������ɶ����������ת��0.03mol��2=0.06mol��
ԭ���غ�õ���Ӧ��FeSO4��0.03mol+0.01mol=0.04mol��
2FeSO4 ��Fe2O3��2e-
2 1 2
0.04mol 0.02mol 0.04mol
FeSO4��O2��4e-
1
0.005mol 0.02mol
��Ӧ��FeSO4��Fe2O3��SO3��SO2��O2=0.04��0.002��0.01��0.012��0.005=8��4��2��6��1
��Ӧ�Ļ�ѧ����ʽΪ��8FeSO4$\frac{\underline{\;����\;}}{\;}$4Fe2O3+2SO3��+6SO2��+O2����
�ʴ�Ϊ��8FeSO4$\frac{\underline{\;����\;}}{\;}$4Fe2O3+2SO3��+6SO2��+O2����
��5������������Ƿ���δ�ֽ���������������ʵ�����ʣ��������Ƿ��������ӣ�����������ӵ����������Լ��ͷ�Ӧ������ƣ����岽��Ϊ������Һ��Ĺ���ת�Ƶ�С�ձ��У���������ˮ������ˣ�ȡ������Һ���Թ��У����뼸��K3[Fe��CN��6]��Һ��������������ɫ������˵����������δȫ���ֽ⣬��֮��ֽ���ȫ��
�ʴ�Ϊ������Һ��Ĺ���ת�Ƶ�С�ձ��У���������ˮ������ˣ�ȡ������Һ���Թ��У����뼸��K3[Fe��CN��6]��Һ��������������ɫ������˵����������δȫ���ֽ⣬��֮��ֽ���ȫ��
���� ���⿼���˷�Ӧ����ķ����жϡ�ʵ������з�Ӧ����Ͳⶨ�������ζ�ʵ����������ͼ��㣬��Ҫ��������ԭ��Ӧ�����غ�ļ������ϻ�ѧ����ʽ�����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�| A�� | Cu+HNO3��Ũ����Cu��NO3��2 | |
| B�� | Cu+HNO3��ϡ����Cu��NO3��2 | |
| C�� | Cu $\frac{����}{����}$ CuO $\frac{����}{\;}$ Cu��NO3��2 | |
| D�� | Cu $\frac{Ũ����}{����}$ CuSO4 $\frac{���ᱵ}{\;}$ Cu��NO3��2 |
| A�� | 0.5 a L | B�� | a L | C�� | 2 a L | D�� | 3 a L |
| A�� |  ��ͼװ��֤���ѣ�ú�ͣ����ѣ��ƣ����ѣ�ˮ�� | B�� |  ��ͼװ���Ʊ�Fe��OH��2 | ||
| C�� |  ��ͼװ����ȡ������ | D�� |  ��ͼװ����ȡ���� |
| A�� | 1��1 | B�� | 2��1 | C�� | 3��2 | D�� | 1��2 |
| A�� | ����λ��Ѱ�� | B�� | ϡ������Ԫ����Ѱ�� | ||
| C�� | �����ͷǽ����ķֽ��ߴ�Ѱ�� | D�� | ���ý����ͻ��÷ǽ�������Ѱ�� |
 ijУ��ѧС��ѧ��������ͼ��ʾװ�ý��С�����ˮ��Ӧ����ʵ�飬��̽���������ɷ֣�ͼ�мгּ�β������װ�þ�����ȥ����
ijУ��ѧС��ѧ��������ͼ��ʾװ�ý��С�����ˮ��Ӧ����ʵ�飬��̽���������ɷ֣�ͼ�мгּ�β������װ�þ�����ȥ����