题目内容
10.科学家们欲寻找一种新型的半导体材料,可以在元素周期表的( )| A. | 任意位置寻找 | B. | 稀有气体元素中寻找 | ||
| C. | 金属和非金属的分界线处寻找 | D. | 活泼金属和活泼非金属区中寻找 |
分析 根据金属和非金属的分界线元素的性质分析.
解答 解:在元素周期表的金属与非金属的分界线附近的元素的金属性和非金属性都较弱,常用于半导体材料,而稀有金属材料和催化剂材料以及耐高温耐腐蚀的合金材料通常属于过渡金属,故选C.
点评 本题考查元素周期表与元素的性质知识,题目较为简单,注意基础知识的积累.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
20.某化学研究小组利用如图装置探究FeSO4分解后的产物.
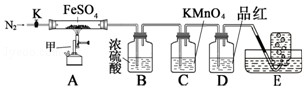
查阅资料得知:SO3溶于水会形成大量的酸雾,工业上通常用浓硫酸做为SO3吸收剂.
实验步骤:按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m g FeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)B中浓硫酸的作用是吸收分解产生的SO3;
(2)实验前通入一段时间N2,目的是排尽装置中的空气;FeSO4完全分解后,还需要通入一段时间N2,原因是将装置内残留的气体排入吸收装置,使其完全被吸收;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
①滴定至终点的现象溶液由紫红色变为无色且半分钟不恢复成紫红色;
②FeSO4分解的化学方程式为8FeSO4$\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(5)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.

查阅资料得知:SO3溶于水会形成大量的酸雾,工业上通常用浓硫酸做为SO3吸收剂.
实验步骤:按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m g FeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)B中浓硫酸的作用是吸收分解产生的SO3;
(2)实验前通入一段时间N2,目的是排尽装置中的空气;FeSO4完全分解后,还需要通入一段时间N2,原因是将装置内残留的气体排入吸收装置,使其完全被吸收;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
| 实验 | 滴定管 开始读数 | 滴定 终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
①滴定至终点的现象溶液由紫红色变为无色且半分钟不恢复成紫红色;
②FeSO4分解的化学方程式为8FeSO4$\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(5)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.
1.下列实验操作中正确的是( )
| A. | 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| B. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
18.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )


| A. | 铜是负极,电子从铜片经导线流向锌片 | |
| B. | 大多数氢离子在锌片上获得电子被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成西红柿汁,导线中不会有电子流动 |
5.用下列装置完成相关实验,合理的是( )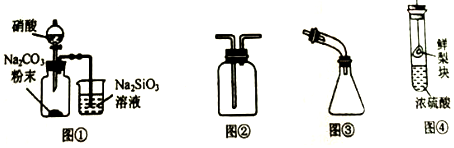

| A. | 图①:证明非金属性由强到弱的顺序是N>C>Si | |
| B. | 图②:收集NO2或NH3 | |
| C. | 图③:海水蒸馏时接收蒸馏水 | |
| D. | 图④:探究浓硫酸的脱水性 |
15.下列现象与氢键有关的是( )
①NH3的熔沸点比同族磷、砷元素氢化物熔沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HF在标况下为液态
⑤H2O比H2S稳定.
①NH3的熔沸点比同族磷、砷元素氢化物熔沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HF在标况下为液态
⑤H2O比H2S稳定.
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①② |
2.某固体化合物的化学式NH5,它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )
| A. | 它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑ | |
| B. | NH5中只有极性共价键的共价化合物 | |
| C. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数) | |
| D. | NH5中所有原子最外层均为8个电子 |
19.研究人员发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的( )
| A. | AgCl是氧化产物 | |
| B. | 每生产1mol Na2Mn5O10转移3mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 正极反应式:Ag+Cl--e-═AgCl |