题目内容
5.将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )| A. | 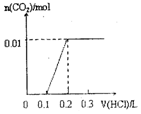 | B. | 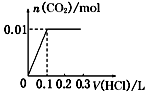 | C. | 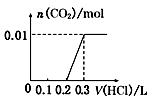 | D. | 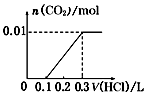 |
分析 对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生NaOH+HCl=NaCl+H2O,再发生Na2CO3+HCl=NaCl+NaHCO3,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,此时才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
解答 解:对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生NaOH+HCl=NaCl+H2O,再发生Na2CO3+HCl=NaCl+NaHCO3,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,此时才有二氧化碳气体生成.
A、0.1mol盐酸与氢氧化钠反应没有气体生成,但碳酸钠与盐酸反应生成碳酸氢钠时也没有气体生成,则图象与反应不符,故A错误;
B、图象中开始反应即有气体生成,与反应不符,故B错误;
C、向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,正好与图象相符,故C正确;
D、因碳酸钠与盐酸的反应分步完成,则碳酸钠与盐酸先反应生成碳酸氢钠和氯化钠,此时没有气体生成,则图象与反应不符,故D错误;
故选C.
点评 此题考查了元素化合物、图象数据的处理知识,解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑.

练习册系列答案
相关题目
10.短周期元素X和Y,可组成化合物XY3.当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a-6,其中正确的组合是( )
| A. | ①② | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
16.Fe、Fe2O3、Fe3O4的混合物中,加入100ml 2mol/L的硫酸,恰好使混合物完全溶解,所得溶液中,加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到的铁的质量为( )
| A. | 22.4g | B. | 11.2g | C. | 5.6g | D. | 无法计算 |
13.已知还原性:SO32->I-.某溶液X可能含有NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,为确定其组成,某同学进行如图实验:下列说法正确的是( )
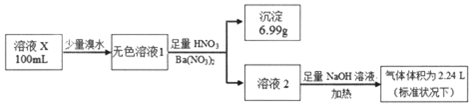

| A. | 溶液X肯定只存在NH4+、SO42- | |
| B. | 溶液X一定不含有Ba2+、Fe3+,可能含有I- | |
| C. | 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液 | |
| D. | 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧 |
20.某化学研究小组利用如图装置探究FeSO4分解后的产物.
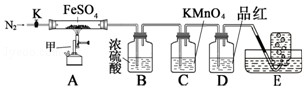
查阅资料得知:SO3溶于水会形成大量的酸雾,工业上通常用浓硫酸做为SO3吸收剂.
实验步骤:按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m g FeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)B中浓硫酸的作用是吸收分解产生的SO3;
(2)实验前通入一段时间N2,目的是排尽装置中的空气;FeSO4完全分解后,还需要通入一段时间N2,原因是将装置内残留的气体排入吸收装置,使其完全被吸收;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
①滴定至终点的现象溶液由紫红色变为无色且半分钟不恢复成紫红色;
②FeSO4分解的化学方程式为8FeSO4$\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(5)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.

查阅资料得知:SO3溶于水会形成大量的酸雾,工业上通常用浓硫酸做为SO3吸收剂.
实验步骤:按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m g FeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)B中浓硫酸的作用是吸收分解产生的SO3;
(2)实验前通入一段时间N2,目的是排尽装置中的空气;FeSO4完全分解后,还需要通入一段时间N2,原因是将装置内残留的气体排入吸收装置,使其完全被吸收;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
| 实验 | 滴定管 开始读数 | 滴定 终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
①滴定至终点的现象溶液由紫红色变为无色且半分钟不恢复成紫红色;
②FeSO4分解的化学方程式为8FeSO4$\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(5)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.
10.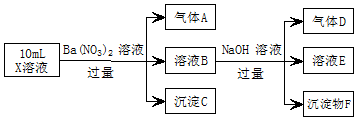 某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
 某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )| A. | A是一种无色、无毒的气体 | |
| B. | 沉淀F为Fe(OH)2 | |
| C. | 实验室可用排水法收集气体D | |
| D. | 往溶液E中通入少量CO2,有沉淀产生 |
17.二元酸H2A在水中的电离方程式是:
H2A═H++HA-;
HA-?H++A2-.
在0.1mol•L-1的Na2A溶液中,下列微粒浓度关系式不正确的是( )
H2A═H++HA-;
HA-?H++A2-.
在0.1mol•L-1的Na2A溶液中,下列微粒浓度关系式不正确的是( )
| A. | c(OH-)═c(H+)+c( HA-) | B. | c(Na+)═2c(A2-)+2c(HA-) | ||
| C. | c(A2-)+c(HA-)+c(H2A)═0.1mol•L-1 | D. | c(Na+)+c(H+)═c(OH-)+c(HA-)+2c(A2-) |
14.下列物质属于纯净物的是( )
| A. | 铝热剂 | B. | 福尔马林 | C. | 干冰 | D. | 碘酒 |