题目内容
1.下列操作或装置能达到实验目的是( )| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. | 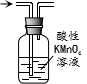 除去甲烷中少量的乙烯得纯净甲烷 |
分析 A.Fe与水蒸气反应生成四氧化三铁、氢气;
B.图示装置中收集氨气的试管不能密封;
C.冷凝管的通水方向不合理,应该采用逆向通水,冷凝效果好;
D.乙烯被酸性高锰酸钾溶液氧化生成二氧化碳,引进了新的杂质.
解答 解:A.Fe与水蒸气反应生成四氧化三铁、氢气,氢气具有可燃性,点燃肥皂泡可检验氢气,故A正确;
B.收集氨气的试管不能密封,试管口应塞一团棉花,故B错误;
C.蒸馏装置中,冷凝管中冷却水应下进上出,冷凝效果较好,而图中冷水方向不合理,故C错误;
D.乙烯被酸性高锰酸钾溶液氧化生成二氧化碳,除去杂质又引进新的杂质,所以不能实现实验目的,可以用溴水除去乙烯,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、制备实验、混合物分离提纯实验、实验技能等,把握反应原理及实验装置的作用、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L NO2溶于水完全反应转移电子数为0.2NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.6NA的乙烯分子中含有的π键数为0.2NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
12.将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
| A. | NO | B. | NO2 | C. | N2O | D. | N2O3 |
16.如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
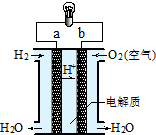

| A. | b极是正极 | |
| B. | 负极的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 电子由a通过灯泡流向b | |
| D. | 氢氧燃料电池是环保电池 |
6.已知:某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是( )
| A. | NaHX的电离方程式为NaHX═Na++H++X2- | |
| B. | HX-的水解程度大于HX-的电离程度 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) | |
| D. | 离子浓度关系:c(Na+)>c(HX-)+c(H2X)+c(X2-) |
14.下列表示对应化学反应离子方程式正确的是( )
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | FeCl3溶液于Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 过量氯气通入FeI2溶液中:3Cl2+2I-+4Fe2+═I2+4Fe3++4Cl- |
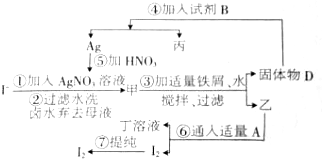 在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘:
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘: