题目内容
12. 甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.Ⅰ.制取氢气
已知:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.4kJ•mol-1
(1)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1
(2)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:
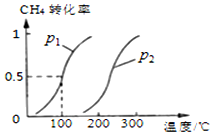
CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率0.003mol/(L.min);
②该反应的化学平衡常数6.75×10-4(mol/L)2;
③图中的p1<p2(填“<”、“>”或“=”);
Ⅱ.制备甲醇
(3)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0.若容器容积不变,下列措施可增加甲醇产率的是BC
A.升高温度 B.再充入1mol CO和3mol H2 C.将CH3OH(g)从体系中分离
D.充入He,使体系总压强增大 E.使用更高效的催化剂
Ⅲ.合成乙酸
(4)甲烷直接合成乙酸具有重要的理论意义和应用价值.光催化反应技术使用CH4和CO2(填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100%).
分析 (1)利用盖斯定律解答,从待求反应出发分析反应物生成物在所给反应中的位置,通过相互加减可得;
(2)①根据图象判断100℃时甲烷的转化率,根据反应方程式及甲烷的物质的量计算出生成氢气的物质的量,再根据反应速率的表达式计算出用H2表示该反应的平均反应速率;
②根据平衡常数的计算公式计算;
③转化率与温度、压强图象有三个变量,采用“定一议二”方法判断压强大小;
(3)根据化学平衡移动原理,增加甲醇产率,使化学平衡正向移动即可;
(4)加成反应的原子利用率100%,再结合原子守恒推断化学式.
解答 解:(1)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1
由盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=$\frac{\frac{1.5mol}{10L}}{5min}$=0.003 mol•L-1•min-1,
故答案为:0.0030mol•L-1•min-1;
②该反应的化学平衡常数K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{(\frac{0.5mol}{10L})×(\frac{1.5mol}{10L})^{3}}{(\frac{0.5mol}{10L})×(\frac{1.5mol}{10L})}$=6.75×10-4(mol/L)2,故答案为:6.75×10-4(mol/L)2;
③通过图表可知当温度相同时,p2→p1时,甲烷的转化率提高,平衡向正向移动,正向为气体系数增大的反应,根据减小压强平衡向系数增大的方向移动可知:p1<p2,故答案为:<;
(3)A.该反应是放热的,升高温度,平衡逆向进行,会减小甲醇产率,故A错误;
B.再充入1mol CO和3molH2,增大压强,平衡右移,有利提高甲醇的产率,故B正确;
C.将CH3OH(g)从体系中分离,会促使平衡正向移动,提高甲醇的产率,故C正确;
D.充入He,使体系总压强增大,体积不变,各组分浓度不变,所以平衡不会移动,不会改变甲醇产率,故D错误;
E.使用催化剂能改变反应速率,但平衡不移动,故E错误;
故选BC;
(4)利用加成反应可以使原子利用率100%,现有甲烷(CH4)与另一种化合物发生加成反应生成CH3COOH,根据原子守恒可知另一物质为CO2,故答案为:CO2.
点评 本题考查化学反应速率、平衡常数、化学平衡计算、化学平衡的影响因素及读图能力等,综合性较大,难度中等,知识面广,应加强平时知识的积累.注意控制变量法与定一议二原则应用.

| A. | 增大反应物的浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂虽然不参加化学反应,但能增大单位体积内活化分子的数目,从而增大反应速率 |
| A. | 浓硫酸稀释时应注意将浓硫酸缓缓地倒入盛有水的容量瓶中 | |
| B. | 将11.2L HCl溶于水形成1L溶液,所得溶液的物质的量浓度为0.5mol/L | |
| C. | 0.5mol/L的Na2SO4和1mol/L的NaOH溶液,c(Na+)相同 | |
| D. | 将20g NaOH 溶于1L水中即得到0.5mol/L的NaOH溶液 |
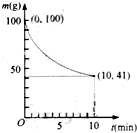 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为: 请根据所学知识回答下列问题:
请根据所学知识回答下列问题:
 .
.