题目内容
8.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)═CO2(g)+H2(g).反应过程中测定的部分数据见表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),△H增大 | |
| D. | 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
分析 A.由表中数据,可知t1min内△n(CO)=1.2mol-0.8mol=0.4mol,由方程式可知△n(H2)=△n(CO)=0.4mol,再根据v=$\frac{△c}{△t}$计算v(H2);
B.t2min时反应的水为0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故t2min时CO为1.2mol-0.4mol=0.8mol,与t1min时CO的物质的量相等,则t1min时到达平衡状态.若保持其他条件不变,起始时向容器中充入0.60molCO(g)和1.20molH2O(g),与原平衡中物质的量互换,二者按物质的量1:1反应,平衡常数不变,则生成物中同种物质的浓度相等,恒容条件下同种物质的物质的量相等;
C.△H只与反应物的状态和系数有关,与平衡移动无关;
D.700℃时,向容积为2L的密闭容器中开始通入1.2molCO(g)和0.6molH2O(g),平衡时水为0.2mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1.2 0.6 0 0
变化量(mol):0.4 0.4 0.4 0.4
平衡量(mol):0.8 0.2 0.4 0.4
故700℃时平衡常数K=$\frac{\frac{0.4}{2}×\frac{0.4}{2}}{\frac{0.8}{2}×\frac{0.2}{2}}$=1,若温度升至800℃,上述反应平衡常数为0.64,小于700℃时平衡常数K=1,说明升高温度平衡逆向移动,升高温度平衡向吸热反应移动.
解答 解:A.由表中数据,可知t1min内△n(CO)=1.2mol-0.8mol=0.4mol,由方程式可知△n(H2)=△n(CO)=0.4mol,则v(H2)=$\frac{\frac{0.4mol}{2L}}{t{\;}_{1}min}$=$\frac{0.2}{t{\;}_{1}}$mol/(L.min),故A错误;
B.t2min时反应的水为0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故t2min时CO为1.2mol-0.4mol=0.8mol,与t1min时CO的物质的量相等,则t1min时到达平衡状态,平衡时二氧化碳为0.4mol.若保持其他条件不变,起始时向容器中充入0.60molCO(g)和1.20molH2O(g),与原平衡中物质的量互换,二者按物质的量1:1反应,平衡常数不变,则生成物中同种物质的浓度相等,恒容条件下同种物质的物质的量相等,故到达平衡时n(CO2)=0.40mol,故B正确;
C.△H只与反应物的状态和系数有关,与平衡移动无关,所以保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),虽然平衡正向移动,但△H不变,故C错误;
D.700℃时,向容积为2L的密闭容器中开始通入1.2molCO(g)和0.6molH2O(g),平衡时水为0.2mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1.2 0.6 0 0
变化量(mol):0.4 0.4 0.4 0.4
平衡量(mol):0.8 0.2 0.4 0.4
故700℃时平衡常数K=$\frac{\frac{0.4}{2}×\frac{0.4}{2}}{\frac{0.8}{2}×\frac{0.2}{2}}$=1,若温度升至800℃,上述反应平衡常数为0.64,小于700℃时平衡常数K=1,说明升高温度平衡逆向移动,升高温度平衡向吸热反应移动,则正反应为放热反应,故D错误,
故选:B.
点评 本题考查化学平衡计算,涉及反应速率计算、平衡常数应用与影响因素,侧重考查学生对数据的分析处理能力,难度中等.

| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 15.0 | 16.1 | 17.7 |
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;此时,该可逆反应是否达到平衡?否(填“是”或“否”)
(3)在此密闭容器中,下列选项能作为判断该反应达到平衡的依据有abd
a.压强不随时间改变 b.气体的密度不随时间改变
c.单位时间内消耗A和B的物质的量相等 d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.067.
| A. | 0.5mol/L | B. | 5mol/L | C. | 10mol/L | D. | 20mol/L |
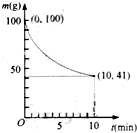 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
 请根据所学知识回答下列问题:
请根据所学知识回答下列问题: