题目内容
(1)实验室需要0.1mol/LNaOH溶液450ml和0.5mol/L硫酸溶液450ml.根据这两种溶液的配制情况回答下列问题:如图1所示.
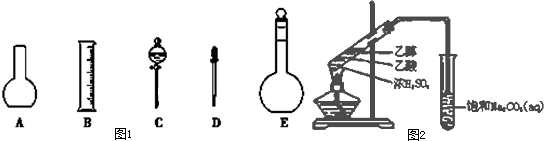
①配制上述溶液肯定不需要的是 (填名称);
②本实验所需仪器E的规格 ml.
(2)实验室用如图2所示的装置制取乙酸乙酯.
①饱和Na2CO3溶液的作用是 (至少写出2个作用).
②生成的乙酸乙酯的化学方程式 .

①配制上述溶液肯定不需要的是
②本实验所需仪器E的规格
(2)实验室用如图2所示的装置制取乙酸乙酯.
①饱和Na2CO3溶液的作用是
②生成的乙酸乙酯的化学方程式
考点:配制一定物质的量浓度的溶液,乙酸乙酯的制取
专题:实验题
分析:(1)根据配制一定物质的量浓度溶液用到仪器选择;根据配制溶液的体积选择容量瓶的规格;
(2)用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;
乙醇与乙酸在浓硫酸催化作用下,发生酯化反应,依据“酸去羟基,醇去氢”写出化学方程式.
(2)用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;
乙醇与乙酸在浓硫酸催化作用下,发生酯化反应,依据“酸去羟基,醇去氢”写出化学方程式.
解答:
(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有烧杯和分液漏斗,要配置450ml溶液应选择500ml容量瓶;
故答案为:烧杯、分液漏斗;500;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
故答案为:吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
(3)乙醇与乙酸发生酯化反应的方程式:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O;
故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O.
故答案为:烧杯、分液漏斗;500;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
故答案为:吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
(3)乙醇与乙酸发生酯化反应的方程式:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
点评:本题考查了一定物质的量浓度溶液的配制,乙酸乙酯的制备,题目难度不大,注意容量瓶选择的原则、酯化反应的原理是解题关键.

练习册系列答案
相关题目
下列事实不能说明一元酸HA是弱酸的是( )
| A、中和一定的NaOH溶液,需消耗与NaOH等物质的量的HA |
| B、将pH=4的HA溶液稀释10倍,溶液pH小于5 |
| C、将pH=2的HA溶液与pH=12的NaOH溶液等体积混合后,溶液呈酸性 |
| D、将0.1mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,溶液呈碱性 |
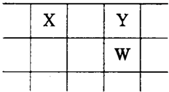 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )| A、五种元素中,X最难形成离子化合物 |
| B、五种元素中,Q的最高价含氧酸的酸性强 |
| C、Y的简单阴离子比W的简单阴离子还原性强 |
| D、Z与Q形成的化合物水溶液一定显酸性 |

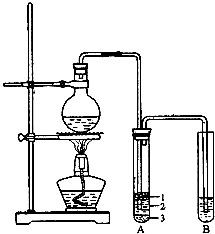 实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空: