题目内容
已知3mol/L H2SO4溶液,其密度为1.18g/cm3,求H2SO4的质量分数.
考点:溶液中溶质的质量分数及相关计算,物质的量浓度的相关计算
专题:计算题
分析:根据c=
计算该H2SO4的质量分数.
| 1000ρw |
| M |
解答:
解:根据c=
可知:3mol/L=
,则w=
=25%,
答:该H2SO4的质量分数为25%.
| 1000ρw |
| M |
| 1000×1.18g/Lw |
| 98g/mol |
| 3×98 |
| 1180 |
答:该H2SO4的质量分数为25%.
点评:本题考查物质的量浓度有关计算,难度中等,注意理解物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
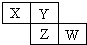 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、Y的氢化物沸点较高是因为其相对分子质量比较大 |
| B、W的最高价氧化物对应水化物的酸性比Z的强 |
| C、Z的非金属性比Y的强 |
| D、X与Y形成的化合物中既有离子键又有共价键 |