题目内容
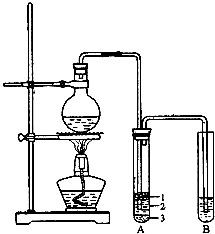 实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:(1)圆底烧瓶中加入的反应物是溴化钠、
a.天平 b.量筒 c.容量瓶 d.滴管
(2)写出加热时烧瓶中发生的主要反应的化学方程式
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是
试管A中的物质分为三层(如图所示),产物在第
(4)试管A中除了产物和水之外,还可能存在
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:
分离A中粗产品所需的主要玻璃仪器是:
考点:溴乙烷的制取
专题:实验题
分析:(1)从制取的目标物质以及有机物的性质角度,结合质量守恒定律来分析,根据仪器的使用方法和实验的目的来选择所需仪器;
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应;
(3)根据实验仪器的特点和有机物的性质来分析;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离;在加热温度较高时,乙醇发生消去反应生成乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶;溴乙烷不溶于水,分离互不相溶的液体的方法是分液;溴乙烷沸点较低,可通过蒸馏提纯.
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应;
(3)根据实验仪器的特点和有机物的性质来分析;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离;在加热温度较高时,乙醇发生消去反应生成乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶;溴乙烷不溶于水,分离互不相溶的液体的方法是分液;溴乙烷沸点较低,可通过蒸馏提纯.
解答:
解:(1)实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应,二者在加热下发生取代反应生成溴乙烷;此实验量取溶液的体积要求精确度不是很高,可用量筒量取,故答案为:乙醇; b;
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,方程式为NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
CH3CH2Br+H2O,
故答案为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
CH3CH2Br+H2O;
(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,
故答案为:冷却、液封溴乙烷; 3;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,
故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离.,在加热温度较高时,乙醇发生消去反应生成乙烯,
故答案为:d; 乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶,应用玻璃导管;溴乙烷不溶于水,分离互不相溶的液体的方法是分液,用到的玻璃仪器为分液漏斗;溴乙烷沸点较低,可通过蒸馏提纯.
故答案为:反应会产生Br2,腐蚀橡胶;分液漏斗;蒸馏.
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,方程式为NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
| 加热 |
故答案为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
| 加热 |
(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,
故答案为:冷却、液封溴乙烷; 3;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,
故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离.,在加热温度较高时,乙醇发生消去反应生成乙烯,
故答案为:d; 乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶,应用玻璃导管;溴乙烷不溶于水,分离互不相溶的液体的方法是分液,用到的玻璃仪器为分液漏斗;溴乙烷沸点较低,可通过蒸馏提纯.
故答案为:反应会产生Br2,腐蚀橡胶;分液漏斗;蒸馏.
点评:本题主要考察溴乙烷大制备、提纯、有机反应等复杂性以及实验安全等知识,题目难度中等,建议同学们精心选择一些取之于教材,但又高于教材的习题.这类题的答案就在教材之中,若不重视教材就很难取得好成绩.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
节能减排对发展经济,保护环境有重要意义.下列措施不能减少二氧化碳排放的是( )
| A、利用太阳能制氢 |
| B、推广使用煤液化技术 |
| C、举行“地球一小时”熄灯活动 |
| D、关停小火电企业 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,15 g甲基(-CH3)所含的电子数为7NA |
| B、水的摩尔质量就是NA个水分子的质量之和 |
| C、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D、1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子 |