题目内容
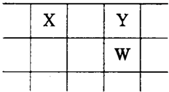 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )| A、五种元素中,X最难形成离子化合物 |
| B、五种元素中,Q的最高价含氧酸的酸性强 |
| C、Y的简单阴离子比W的简单阴离子还原性强 |
| D、Z与Q形成的化合物水溶液一定显酸性 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,则W为S元素,可推知,X为C元素、Y为O元素,Q为Cl元素,则Z可能为Na或Mg或Al,据此解答.
解答:
解:X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,则W为S元素,可推知,X为C元素、Y为O元素,Q为Cl元素,则Z可能为Na或Mg或Al,
A.X为C元素,最外层电子数为4,不容易获得电子,也不容易获得电子,最难形成离子化合物,故A正确;
B.Q为Cl元素,高氯酸的酸性最强,故B正确;
C.非金属性Y>W,故Y的简单阴离子比W的简单阴离子还原性弱,故C错误;
D.Q为Cl元素,Z可能为Na或Mg或Al,Z与Q形成的化合物为氯化铝时,溶液中铝离子水解,溶液呈酸性,为NaCl,溶液呈中性,故D错误,
故选CD.
A.X为C元素,最外层电子数为4,不容易获得电子,也不容易获得电子,最难形成离子化合物,故A正确;
B.Q为Cl元素,高氯酸的酸性最强,故B正确;
C.非金属性Y>W,故Y的简单阴离子比W的简单阴离子还原性弱,故C错误;
D.Q为Cl元素,Z可能为Na或Mg或Al,Z与Q形成的化合物为氯化铝时,溶液中铝离子水解,溶液呈酸性,为NaCl,溶液呈中性,故D错误,
故选CD.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意Z元素的不确定性,难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
下列有关结构和性质的说法中,正确的是( )
| A、元素非金属性Cl>S的实验依据是酸性HClO4>H2SO3 |
| B、碳元素的电负性小于氧元素,每个CO2分子中有4个σ键 |
| C、同周期主族元素的原子形成的简单离子的电子层结构一定相同 |
| D、Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na |
节能减排对发展经济,保护环境有重要意义.下列措施不能减少二氧化碳排放的是( )
| A、利用太阳能制氢 |
| B、推广使用煤液化技术 |
| C、举行“地球一小时”熄灯活动 |
| D、关停小火电企业 |
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、Y的氢化物沸点较高是因为其相对分子质量比较大 |
| B、W的最高价氧化物对应水化物的酸性比Z的强 |
| C、Z的非金属性比Y的强 |
| D、X与Y形成的化合物中既有离子键又有共价键 |
用括号中的试剂和方法除去各组物质中的少量杂质,正确的是( )
| A、苯中的甲苯(酸化高锰酸钾溶液 分液) |
| B、乙醇中的水(无水硫酸铜 干燥) |
| C、乙醇中的乙酸(NaOH溶液 分液) |
| D、苯中的溴:(NaOH溶液 分液) |
下列说法正确的是( )
| A、吸热反应不加热就不会发生 |
| B、据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| C、化学反应除了生成新的物质外,还伴随着能量的变化 |
| D、放热的化学反应不需要加热就能发生 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,15 g甲基(-CH3)所含的电子数为7NA |
| B、水的摩尔质量就是NA个水分子的质量之和 |
| C、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D、1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子 |