题目内容
X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,X是短周期中除稀有气体元素外半径最大的元素.下列说法正确的是( )
| A、若X、Y、W形成的化合物为XYW2,则其水溶液可以显碱性 |
| B、Y的最高价氧化物对应的水化物一定是碱 |
| C、稳定性:W的氢化物>Z的氢化物,沸点:Z的氢化物>W的氢化物 |
| D、X、Y的氧化物晶体类型一定相同 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W为短周期元素,X是短周期中除稀有气体元素外半径最大的元素,则X为Na;X、Y、Z处于同一周期,X、Y、Z原子序数之和为40,则Y、Z的原子序数之和=40-11=29,原子半径X>Y>Z>W,Y可能为Mg、Al、Si,对应的Z可能为Cl、S、P,由于Z、W处于同一主族,相应的W为F、O、N,据此解答.
解答:
解:X、Y、Z、W为短周期元素,X是短周期中除稀有气体元素外半径最大的元素,则X为Na;X、Y、Z处于同一周期,X、Y、Z原子序数之和为40,则Y、Z的原子序数之和=40-11=29,原子半径X>Y>Z>W,Y可能为Mg、Al、Si,对应的Z可能为Cl、S、P,由于Z、W处于同一主族,相应的W为F、O、N,
根据Z可以确定W,
A.Y可能为Mg、Al、Si,若Na、Mg、F形成的化合物为XYW2,则为NaAlO2,其水溶液显碱性,故A正确;
B.若Y为Si,最高价氧化物对应的水化物为硅酸,故B错误;
C.非金属性W>Z,稳定性:W的氢化物>Z的氢化物,W的氢化物分子中存在氢键,沸点:Z的氢化物<W的氢化物,故C错误;
D.Na的氧化物属于离子晶体,若Y为Si,其氧化物二氧化硅属于原子晶体,故D错误,
故选A.
根据Z可以确定W,
A.Y可能为Mg、Al、Si,若Na、Mg、F形成的化合物为XYW2,则为NaAlO2,其水溶液显碱性,故A正确;
B.若Y为Si,最高价氧化物对应的水化物为硅酸,故B错误;
C.非金属性W>Z,稳定性:W的氢化物>Z的氢化物,W的氢化物分子中存在氢键,沸点:Z的氢化物<W的氢化物,故C错误;
D.Na的氧化物属于离子晶体,若Y为Si,其氧化物二氧化硅属于原子晶体,故D错误,
故选A.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意元素的不确定性,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池.常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池放电时发生的反应通常表示为LaNi5H6+6NiO(OH)═LaNi5+6Ni(OH)2.下列说法正确的是( )
| A、放电时储氢合金作正极 |
| B、放电时负极反应为:LaNi5H6-6e-═LaNi5+6H+ |
| C、充电时阳极周围c(OH-)减小 |
| D、充电时储氢合金作负极 |
下列各组物质均属于电解质的是( )
| A、SO2、Cl2、氨水 |
| B、AgCl、Ba(OH)2、HClO |
| C、NaOH、HCl、NaCl |
| D、酒精、Cu、蔗糖 |
关于下列各装置图的叙述中,正确的是( )
A、 制取及观察Fe(OH)2 |
B、 比较两种物质的稳定性 |
C、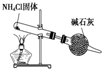 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温常压下,18g H2O含有2NA个O-H键 |
| B、1L 1mol/L Na2CO3溶液中含有NA个CO32- |
| C、1mol Al被完全氧化生成Al2O3,转移6NA个电子 |
| D、常温下,22.4L的N2和O2混合气体,含有2NA个原子 |
能用H++OH-=H2O表示的反应是( )
| A、氢氧化钡溶液与硫酸反应 |
| B、氢氧化铜与稀硝酸反应 |
| C、氢氧化钾与稀盐酸反应 |
| D、氢氧化钠与醋酸溶液反应 |
下列叙述中,不正确的是( )
| A、pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1:10 |
| B、1.0mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/L |