题目内容
20.写出下列物质在水溶液中的电离方程式:(1)H2SO4:H2SO4═2H++SO42-;
(2)NaOH:NaOH=Na++OH-;
(3)Na2CO3:Na2CO3=2Na++CO32-.
分析 分清电解质的强弱,强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答.
解答 解:(1)硫酸是强电解质,电离出氢离子和硫酸根离子,电离方程式为:H2SO4═2H++SO42-,
故答案为:H2SO4═2H++SO42-;
(2)氢氧化钠是强碱,为强电解质,在溶液中完全电离,电离方程式为:NaOH=Na++OH-,
故答案为:NaOH=Na++OH-;
(3)碳酸钠为强电解质,完全电离,其电离方程式为:Na2CO3=2Na++CO32-;
故答案为:Na2CO3=2Na++CO32-.
点评 本题考查电离方程式的书写,题目难度不大,注意原子团的书写及电离方程式应遵循电荷守恒、质量守恒定律,试题侧重基础知识的考查,培养学生的规范答题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.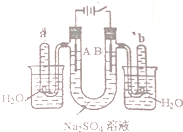 如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
 如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )| A. | 逸出气体的体积,A电极的小于B电极的 | |
| B. | 一电极逸出无味气体,另一电极逸出刺激性气味气体 | |
| C. | A电极附近呈红色,B电极附近呈蓝色 | |
| D. | 电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性 |
16.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| B. | 向10mL1mol/LNa2CO3溶液中逐滴加入5mL1mol/L盐酸:2H++CO${\;}_{3}^{2-}$═CO2↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO${\;}_{3}^{-}$═Ag++NO↑+H2O |
15.下列各原子或离子的电子排布式错误的是( )
| A. | Ca2+1s22s22p63s23p6 | B. | O2-1s22s22p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar1s22s22p63s23p6 |
5.某浓度的氨水中存在下列平衡:NH3•H2O?NH${\;}_{4}^{+}$+OH-,若想增大NH${\;}_{4}^{+}$的浓度,而不增加OH-的浓度,应采取的措施是( )
①适当升高温度 ②加入NH4Cl固体 ③通入NH3 ④加入少量盐酸.
①适当升高温度 ②加入NH4Cl固体 ③通入NH3 ④加入少量盐酸.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
9.下列金属中能溶于稀硫酸,但用它制成的容器适合用来盛装浓硫酸的是( )
| A. | 锌 | B. | 铁 | C. | 铜 | D. | 金 |
10.已知异丙苯的结构简式如图,下列说法错误的是( )
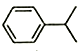

| A. | 异丙苯的分子式为C9H12 | |
| B. | 异丙苯能使酸性高锰酸钾溶液褪色 | |
| C. | 异丙苯中碳原子可能都处于同一平面 | |
| D. | 异丙苯的和苯为同系物 |
 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题: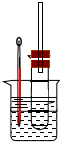 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证