题目内容
12.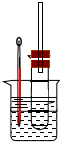 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和5mL 溴乙烷,振荡.
实验操作II:将试管如图固定后,水浴加热.
(1)用水浴加热而不直接用酒精灯加热的原因是溴乙烷沸点低,减少溴乙烷的损失.
(2)观察到管内溶液静置后不分层现象时,表明溴乙烷与NaOH溶液已完全反应.
(3)写出溴乙烷与NaOH溶液发生的反应方程式CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr,为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是生成的气体,检验的方法是将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液)(需说明:所用的试剂、简单的实验操作及预测产生的实验现象).
分析 (1)水浴加热,可提供稳定的加热温度,且避免溴乙烷的挥发;
(2)溴乙烷不溶于水,开始溶液分层,生成物乙醇、溴化钠都溶于水;
(3)溴乙烷与NaOH溶液发生水解反应生成乙醇和溴化钠;溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,乙烯能够使酸性的高锰酸钾褪色(或者使溴的四氯化碳褪色),只要证明乙烯的存在即可证明发生的是消去反应.
解答 解:(1)溴乙烷沸点低,溴乙烷易挥发,用水浴加热热均匀,减少溴乙烷的损失.
故答案为:溴乙烷沸点低,减少溴乙烷的损失;
(2)溴乙烷不溶于水,开始溶液分层,生成物乙醇、溴化钠都溶于水,当溶液分层消失,表明溴乙烷与NaOH溶液已完全反应.
故答案为:试管内溶液静置后不分层;
(3)溴乙烷与NaOH溶液发生水解反应生成乙醇和溴化钠,反应的方程式为CH3CH2Br+NaOH $→_{△}^{水}$CH3CH2OH+NaBr,溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,只有证明乙烯的存在即可证明发生的是消去反应,方法是:将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色),
故答案为:CH3CH2Br+NaOH $→_{△}^{水}$CH3CH2OH+NaBr;生成的气体;将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液).
点评 考查卤代烃的性质、反应原理的探究、对实验装置的理解等,难度不大,注意(2)中取代反应实质是,溴乙烷与是发生取代反应生成乙醇与氢溴酸,氢溴酸与氢氧化钠反应生成溴化钠与水,所以还发生中和反应.

练习册系列答案
相关题目
3.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g)△H=+Q kJ•mol-1(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol•L-1,则H2的反应速率为0.03 mol•(L•min-1) | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液中恰好反应 |
17.下列物质的分子中,只由σ键形成的是( )
| A. | 氮气 | B. | 甲烷 | C. | 乙烯 | D. | 乙炔 |
2.下列物质属于纯净物的是( )
| A. | 氢氧化铁胶体 | B. | 碘酒 | C. | 胆矾(CuSO4•5H2O ) | D. | 生铁 |
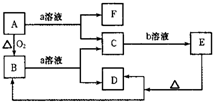 已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.
已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.
 两种有机物的结构简式
两种有机物的结构简式 ;
; .
.
 如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.
如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.