题目内容
氢氟酸(HF)是一种弱酸.25℃时,向20mLO.1mol?L-1氢氟酸中加入VmL0.1mol?L-1NaOH溶液充分反应.已知:HF(aq)+OH-(aq)═F-(aq)+H2O(1)△H=-67.7kJ?mol-1,H+(aq)+OH-(aq)═H2O(1)△H═-57.3
kJ?mol- 根据题意,下列判断或结论正确的是( )
kJ?mol- 根据题意,下列判断或结论正确的是( )
| A、氢氟酸的电离过程是吸热的 |
| B、当V=20时,溶液中:c(F-)<c(Na+)=0.1mol?L-1 |
| C、当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) |
| D、当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+) |
考点:弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:A.利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应,然后判断;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,可根据电荷守恒判断,溶液的体积变大为原来的2倍;
C.当V<20时,结合电荷守恒判断;
D.溶液离子浓度大小关系取决于V,V不同,浓度关系可能不同.
B.当V=20时,恰好反应生成NaF,溶液呈碱性,可根据电荷守恒判断,溶液的体积变大为原来的2倍;
C.当V<20时,结合电荷守恒判断;
D.溶液离子浓度大小关系取决于V,V不同,浓度关系可能不同.
解答:
解:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ?mol-1,所以氢氟酸的电离过程是放热的,故A错误;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,根据电荷守恒可得c(F-)+c(OH-)=c(Na+)+c(H+),又因为c(OH-)>c(H+),所以c(F-)<c(Na+)=0.05mol?L-1,故B错误;
C.当V=20时,恰好反应生成NaF,溶液显碱性,所以当V<20时,溶液可能显中性,根据电荷守恒c(F-)+c(OH-)=c(Na+)+c(H+),则c(Na+)=c(F-),故C正确;
D.溶液离子浓度大小关系取决于V,V不同,浓度关系可能不同,当NaOH溶液的体积远大于20ml时,c(OH-)会大于c(F-),故D错误;
故选C.
B.当V=20时,恰好反应生成NaF,溶液呈碱性,根据电荷守恒可得c(F-)+c(OH-)=c(Na+)+c(H+),又因为c(OH-)>c(H+),所以c(F-)<c(Na+)=0.05mol?L-1,故B错误;
C.当V=20时,恰好反应生成NaF,溶液显碱性,所以当V<20时,溶液可能显中性,根据电荷守恒c(F-)+c(OH-)=c(Na+)+c(H+),则c(Na+)=c(F-),故C正确;
D.溶液离子浓度大小关系取决于V,V不同,浓度关系可能不同,当NaOH溶液的体积远大于20ml时,c(OH-)会大于c(F-),故D错误;
故选C.
点评:本题考查酸碱混合的计算和判断,题目难度中等,注意盖斯定律的运用,易错点为D,注意V对溶液酸碱性的影响.

练习册系列答案
相关题目
通过NOx传感器可监测NOx的含量,其工作原理示意图如图,下列说法正确的是( )
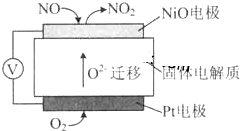

| A、NiO电极是该电池的正极 |
| B、Pt电极附近的pH增大 |
| C、NiO电极的电极反应式:NO-2e-+O2-═NO2 |
| D、固体电解质中O2-向正极移动 |
下列属于水解离子方程式且正确的是( )
| A、NH3+H2O?NH4++OH- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、HCO3-+H2O?H3O++CO32- |
以下离子方程式的书写正确的是( )
| A、氧化铁和稀盐酸:FeO+2H+=Fe2++H2O |
| B、向NaOH溶液中通Cl2:2OH-+Cl2=Cl-+ClO-+H2O |
| C、向AlCl3溶液中加过量强碱:Al3++3OH-=Al(OH)3↓ |
| D、给漂白粉溶液中加入盐酸:Ca(ClO2)+2H+=2HClO+Ca2+ |
 难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(g)+2I2(g)
难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(g)+2I2(g)| 1123K |
| 1023K |
| A、在不同温度区域,TaI4的量不同 |
| B、在提纯过程中,S2的量不断增多 |
| C、该反应的平衡常数不随TaI4和S2的浓度增大而增大 |
| D、在提纯过程中,I2的作用是将TaS2从高温区转移到低温区 |
下列离子方程式书写正确的是( )
| A、氨气通入醋酸溶液中:NH3+H+=NH4+ | ||||
| B、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O | ||||
| C、硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++2H++H2O2=2Fe3++2H2O | ||||
D、用惰性电极电解硫酸铜溶液:Cu2++2H+
|
 2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.