题目内容
12.表中所列字母分别代表一种元素.
(1)G的气态氢化物比J的气态氢化物稳定(填“稳定”或“不稳定”).
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).(3)元素C和H的最高价氧化物对应的水化物相互反应的离子方程式为:Al(OH)3+OHˉ=AlO2ˉ+2H2O.
(4)元素G和L的原子序数相差:26,它们的氢化物的水溶液酸性相对强的是:HBr(填化学式)
(5)表中A和F两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为:AC
A.MnO2 B.Na2SO4 C.FeCl3 D.KMnO4
(6)K为生产、生活中应用最广泛的金属,通常采用的冶炼方法为:C
A、电解法 B、热分解法 C、热还原法.
分析 由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为氟、H为Al、I为Si、J为Cl、K为Fe、L为Br.
(1)元素非金属性越强,对应氢化物越稳定;
(2)在一定条件下,氢与氮可形成一种极易溶于水的气态化合物为NH3;
(3)元素C和H的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(4)元素G和L同主族,且处于过渡元素之后,原子相差为第三周期、第四周期容纳元素种数之和;HF属于弱酸,而HBr属于强酸;
(5)氢、氧两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应;
(6)工业通常利用CO还原氧化铁冶炼铁.
解答 解:由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为氟、H为Al、I为Si、J为Cl、K为Fe、L为Br.
(1)金属性F>Br,元素非金属性越强,对应氢化物越稳定,故HF比HBr更稳定,
故答案为:稳定;
(2)在一定条件下,氢与氮可形成一种极易溶于水的气态化合物为NH3,其电子式为 ,该物质溶于水后的溶液呈碱性,
,该物质溶于水后的溶液呈碱性,
故答案为: ;碱;
;碱;
(3)元素C和H的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,离子反应方程式为:Al(OH)3+OHˉ=AlO2ˉ+2H2O,
故答案为:Al(OH)3+OHˉ=AlO2ˉ+2H2O;
(4)元素G和L同主族,且处于过渡元素之后,原子相差为第三周期、第四周期容纳元素种数之和,即二者原子序数相差为8+18=26;HF属于弱酸,而HBr属于强酸,故水溶液酸性相对强的是HBr,
故答案为:26;HBr;
(5)氢、氧两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:AC;
(6)工业通常利用CO还原氧化铁冶炼铁,属于热还原法,
故答案为:C.
点评 本题考查元素周期表与元素周期律、元素化合物性质、常用化学用语、金属冶炼等,注意掌握中学常见化学工业,理解同主族原子序数关系.

| A. | 它是第Ⅷ族元素 | |
| B. | 它是第六周期元素 | |
| C. | 它属于过渡元素 | |
| D. | 它的某种同位素核内中子数大于质子数 |
| A. | 核内质子数 | B. | 核外电子数 | C. | 核外电子层数 | D. | 中子数 |
| A. | ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含共价键的离子化合物 | |
| B. | 在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 | |
| C. | HI的相对分子质量比HF大,所以HI的沸点比HF高 | |
| D. | H与D、16O与18O互为同位素;H216O、D216O、H218O、D216O互为同素异形体 |
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | a | |||||||
| 二 | d | e | h | |||||
| 三 | b | c | f | g |
(1)单质氧化性最强的是F2,金属性最强的是Na.
(2)最高价氧化物对应的水化物中,碱性最强的是NaOH、酸性最强的是HClO4.
(3)原子半径最大的元素是NaOH.
(4)f、g和h的气态氢化物的稳定性由强到弱的顺序是HF>HCl>PH3.
(5)b和c两者的最高价氧化物对应的水化物间反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,c和e两者的最高价氧化物对应的水化物间反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(6)在b、c、g、h中,离子半径最大的是Cl-.
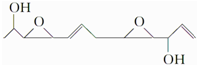 下列关于该化合物的说法正确的是( )
下列关于该化合物的说法正确的是( )| A. | 分子式为C12H19O4 | B. | 是乙醇的同系物 | ||
| C. | 可发生氧化反应 | D. | 处于同一平面的原子最多有5个 |
①烧杯 ②坩埚 ③烧瓶 ④试管 ⑤锥形瓶 ⑥蒸发皿 ⑦容量瓶 ⑧表面皿.
| A. | ①③⑤⑦⑧ | B. | ①③④⑤⑦ | C. | ④⑦⑧ | D. | ②③⑤⑦⑧ |
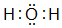 .
.