题目内容
17.有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.(1)A2B的电子式为
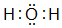 .
.(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示).
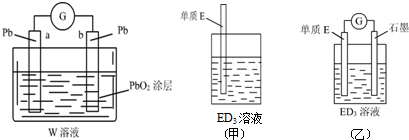
在b电极上发生的反应可表示为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为Pb-2e-+SO42-=PbSO4.若电池工作一段时间后,a极消耗0.05mol Pb,则W的浓度由质量分数39% (密度1.3g/cm3)变为5.07mol/L.
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为Fe+2Fe3+=3Fe2+.
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为2Fe3++2e-=2Fe2+.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是使还原反应和氧化反应在电解质溶液中的不同区域内发生.
分析 有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)A2B为H2O,属于共价化合物,分子中氧原子与H原子之间形成1对共用电子对;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,b电极发生还原反应,则a电极发生还原反应,Pb失去电子生成PbSO4;
反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,计算消耗H2SO4的物质的量,可得硫酸浓度减小量,根据c=$\frac{1000ρw}{M}$计算原溶液中硫酸物质的量浓度,进而计算一段时间后硫酸的物质的量浓度;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+.
解答 解:有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)A2B为H2O,属于共价化合物,其电子式为: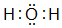 ,
,
故答案为: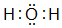 ;
;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,b电极发生还原反应,则a电极发生还原反应,Pb失去电子生成PbSO4,负极电极反应式为:Pb-2e-+SO42-=PbSO4,
反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,a极消耗0.05mol Pb,则消耗0.1molH2SO4,已知溶液体积为1L,硫酸浓度减小量为$\frac{0.1mol}{1L}$=0.1mol/L,原H2SO4溶液的质量分数39% (密度1.3g/cm3),则一段时间后溶液中c(H2SO4)=$\frac{1000×1.3×39%}{98}$mol/L-$\frac{0.1mol}{1L}$=5.07mol/L,
故答案为:Pb-2e-+SO42-=PbSO4;5.07;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,负极电极反应式为:Fe-2e-=Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+,正极电极反应式为:2Fe3++2e-=2Fe2+.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是:使还原反应和氧化反应在电解质溶液中的不同区域内发生,
故答案为:2Fe3++2e-=2Fe2+;使还原反应和氧化反应在电解质溶液中的不同区域内发生.
点评 本题以元素推断为载体,考查电子式、原电池原理的应用、化学计算等,题目难度中等,正确推断元素的种类为解答该题的关键,注意掌握原电池中电极方程式的书写.

| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、HCO32- | D. | Na+、Cu2+、Cl-、SO42- |
| A. | 根据系统命名法,CH3-CH=CH-CHO的名称是:丁烯醛 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
| A. | 浓硫酸中硫酸物质的量浓度为18.4 mol/L | |
| B. | 配制溶液所需浓硫酸体积为24mL | |
| C. | 配制溶液时仅需的仪器有容量瓶、烧杯、玻璃棒、量筒 | |
| D. | 配制溶液时,量取硫酸注入到烧杯中,加水稀释,冷却后再转移到容量瓶中 |

 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).