题目内容
1.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图: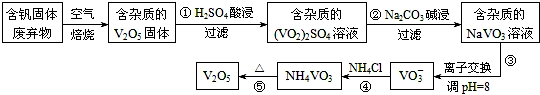
部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
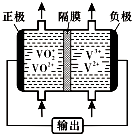
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
分析 反应①用硫酸溶解含钒固体废弃物(含有SiO2、Al2O3及其他残渣),生成(VO2)2SO4和硫酸铝,SiO2等不溶性杂质过滤除去;反应②是用碳酸钠溶液与(VO2)2SO4和硫酸铝反应,与(VO2)2SO4反应生成NaVO3,碳酸根离子与铝离子水解相互促进生成Al(OH)3沉淀;反应④是NaVO3溶液与氯化铵反应生成NH4VO3沉淀,加热NH4VO3分解为V2O5,据此解答(1)(2)(3);
(4)据已知热化学方程式和待求热化学方程式,利用盖斯定律计算;
(5)钒液流电池放电时负极发生氧化反应,正极发生还原反应,充电时,阳极发生氧化反应;
(6)先据反应方程式和滴定数据计算(VO2)2SO4溶液中c(VO2+)的物质的量浓度,再计算该(VO2)2SO4溶液中钒的含量.
解答 解:(1)用硫酸溶解含钒固体废弃物(含有SiO2、Al2O3及其他残渣),生成(VO2)2SO4和硫酸铝,溶液中的阳离子除氢离子外还有VO2+和Al3+,
故答案为:VO2+和Al3+;
(2)含杂质的(VO2)2SO4溶液用碳酸钠溶液碱浸生成含杂质的NaVO3溶液,Al(OH)3不溶于弱碱,所以反应②碱浸后滤出的固体主要成分是Al(OH)3,
故答案为:Al(OH)3;
(3)据工艺流程图可知,反应④的离子方程式为VO3-+NH4+=NH4VO3,故答案为:VO3-+NH4+=NH4VO3↓;
(4)已知①4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
②4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
据盖斯定律,(①×5-②×3)÷2得:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol,
故答案为:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol;
(5)钒液流电池放电时负极发生氧化反应,据图可知,电极反应式为V2+-e-=V3+,正极发生还原反应,充电时,阳极发生氧化反应,电极反应式为VO2+-e-+H2O=VO2++2H+,
故答案为:V2+-e-=V3+;VO2+-e-+H2O=VO2++2H+;
(6)据滴定数据,结合离子方程式c(VO2+)=$\frac{2×25.0mL×0.100mol/L}{24.0mL}$=0.2083mol/L,所以1L溶液中含V的质量为0.2083mol/L×1L×51g/mol=10.6g,
故答案为:10.6.
点评 本题通过从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程考查了氢氧化铝的两性、离子方程式书写、盖斯定律、电极反应式书写以及物质含量的计算,题目难度较大.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案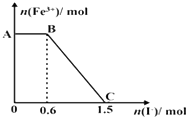
| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成 |
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
| A. | Cu和Na | B. | Fe和Cu | C. | Cu与Al | D. | Al与Na |
| A. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者所用时间少 | |
| B. | 常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-) 之比为2:1 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |

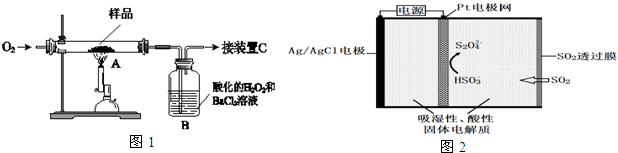
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生 成 H3PO3和HC1;③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)F中碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
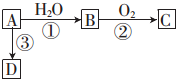 已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.
已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.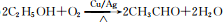 .
.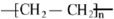 .
.