题目内容
20.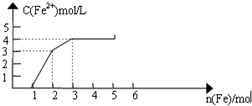 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )| A. | 1:8 | B. | 1:9 | C. | 3:8 | D. | 1:11 |
分析 依据氧化还原反应的顺序规律分析计算,溶液中含有Fe (NO3) 3、Cu (NO3) 2、HNO3,氧化性顺序为HNO3>Fe (NO3) 3>Cu (NO3) 2,加入铁后依次反应,据此结合图象数据计算.
解答 解:稀溶液中各物质的氧化性顺序为HNO3>Fe(NO3)3>Cu(NO3) 2,加入铁后会依次发生氧化还原反应,
①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+;
从图象中可知铁为1mol时,无Fe2+生成,发生的反应是①消耗硝酸为4mol,生成Fe3+1mol;
再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;
再加入1mol铁发生反应③,此时又生成Fe2+物质的量为1mol,说明原溶液中Cu2+物质的量为1mol;
综上所述可知原溶液中Fe (NO3) 3为1mol,Cu (NO3) 2物质的量为1mol,HNO3物质的量为4mol,
则原溶液中Fe3+与NO3-物质的量浓度之比比为:1mol:(1mol×3+1mol×2+4mol×1)=1:9,
故选B.
点评 本题考查了铁及其化合物的性质应用、混合物反应的计算,题目难度中等,明确氧化还原反应的顺序为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
10.实验室用电石和水反应制取的乙炔中常常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,下列实验方案最简便易行的是( )
| A. | 通过NaOH溶液后再通过浓硫酸 | B. | 通过CuSO4溶液后再通过石灰水 | ||
| C. | 通过P2O5后再通过固体NaOH | D. | 通过碱石灰 |
8. 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
下列叙述错误的是( )
 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:下列叙述错误的是( )
| A. | 溶液中一定含有NH4+、C032- | |
| B. | 溶液中离子浓度c(Na+)=c(S042一) | |
| C. | 溶液中一定不含Mg2+、Al3+、Fe3+ | |
| D. | 溶液可能是由Na2C03与(NH4)2S04组成的混合溶液 |
5.下列表述正确的是( )
| A. | SO3和NxOy都属于酸性氧化物 | |
| B. | 实验室制取氯气时,先加热二氧化锰,后滴入浓盐酸 | |
| C. | 锶与镁、钙、钡同族,由于碳酸钙和碳酸钡都难溶,所以碳酸锶也难溶 | |
| D. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 |
9.已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )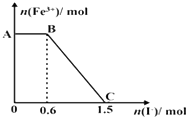

| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成 |
10.下列有关说法正确的是( )
| A. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者所用时间少 | |
| B. | 常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-) 之比为2:1 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
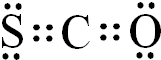 .
.