题目内容
12. I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.II.把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6LH2(标准状况下).
(1)合金中镁的物质的量0.1mol.
(2)写出该合金溶于足量NaOH溶液的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.同时产生H2的体积(标准状况下)为3.36L.
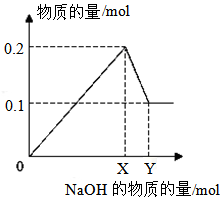
III.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:
①生成Mg(OH)2的质量为5.8g;
②X=0.5;Y=0.6.
分析 I.(1)氯离子的浓度为氯化钡浓度的2倍;根据n=cV计算出钡离子的物质的量;
II.(1)由于盐酸过量,则镁、铝都完全反应,根据金属的质量关系和得失电子守恒来列方程计算Mg、Al的各自物质的量;
(2)镁和NaOH不反应,铝和NaOH溶液反应生成NaAlO2和H2;据V=nVm计算;
III.①由图可知氢氧化镁的物质的量为0.1mol,据m=nM求其质量;
②氢氧化铝的物质的量也是0.1mol,根据元素守恒,所以X的物质的量为0.1×2+0.1×3=0.5mol,Y的物质的量为:0.1mol的氢氧化铝消耗的氢氧化钠为0.1mol,所以Y的值为0.6mol.
解答 解:I.(1)20mL 0.1mol/LBaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(BaCl2)=0.1mol/L×2=0.2mol/L;
Ba2+的物质的量浓度为0.1mol/L,该溶液中含有钡离子的物质的量为:0.1mo/L×0.02L=0.002mol,
故答案为:0.2mol/L;0.002mol;
II.(1)标准状况下,氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,
因盐酸足量,金属完全反应,设镁、铝的物质的量分别为x mol和y mol,则:
$\left\{\begin{array}{l}{24x+27y=5.1}\\{2x+3y=0.25×2}\end{array}\right.$,解得x=0.1,y=0.1mol,故n(Mg)=0.1mol,n(Al)=0.1mol,
故答案为:0.1mol;
(2)镁和NaOH不反应,铝和NaOH溶液反应生成NaAlO2和H2,故方程式为 2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.1 0.15
则:n(H2)=0.15mol,V(H2)=0.15mol×22.4L/mol=3.36L,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;3.36L;
III.①由图可知氢氧化镁的物质的量为0.1mol,所以质量为0.1mol×58g/mol=5.8g,
故答案为:5.8g;
②由①分析得X的物质的量为0.1×2+0.1×3=0.5mol,Y的物质的量为:0.1mol的氢氧化铝消耗的氢氧化钠为0.1mol,所以Y的值为0.6mol,
故答案为:0.5; 0.6.
点评 本题属于综合体,主要考查混合物计算,金属与酸,碱的反应,比较基础,也可以利用方程式进行解答.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案| A. | H2(g)+Br2(g)?2HBr(g) | B. | N2(g)+3H2(g)?2NH3(g) | C. | 2SO2(g)+O2(g)?2SO3(g) | D. | C(s)+CO2(g)?2CO(g) |
| A. | 电解熔融态的Al2O3、12C转化为14C都属于化学变化 | |
| B. | 胆矾、冰水混合物、四氧化三铁都是纯净物 | |
| C. | 根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 | |
| D. | SiO2、NO2、Al2O3都属于酸性氧化物 |
| A. | Na+﹑Ca2+﹑Cl-﹑CO32- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Cu2+﹑Cl-﹑Ca2+﹑NO3- | D. | NO3-﹑Na+﹑Ca2+﹑Cl- |
| A. | pH=l的溶液中:Na+、I-、NO3-、SO42- | |
| B. | 氢氧化铁胶体中:H+、K+、Cl-、S2- | |
| C. | 在pH=0的溶液中:Na+、NH4+、CH3COOH、Cl- | |
| D. | 水电离产生的c(H+)=1×10-12mol•L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
(1)求所得盐酸的物质的量浓度5mol/L
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度0.25mol/L.
| A. | 甲烷分子的球棍模型  | B. | 醛基的电子式  | ||
| C. | 乙酸的结构简式 C2H4O2 | D. | 乙烯的最简式为 CH2 |