题目内容
3.下列叙述正确的是( )| A. | 1molCO2的质量为44g/mol | |
| B. | H2SO4的摩尔质量为98 | |
| C. | 标准状况下,气体摩尔体积约为22.4L | |
| D. | O2的相对分子质量为32 |
分析 A、质量的单位为g;
B、摩尔质量的单位为g/mol;
C、气体摩尔体积的单位为L/mol;
D、O的相对原子质量为16.
解答 解:A、质量的单位为g,故1mol二氧化碳的质量为44g,故A错误;
B、一种物质的摩尔质量在数值上等于该物质的相对分子质量,摩尔质量的单位为g/mol,故硫酸的摩尔质量为98g/mol,故B错误;
C、气体摩尔体积的单位为L/mol,故标况下,气体摩尔体积为22.4L/mol,故C错误;
D、O的相对原子质量为16,故氧气的相对分子质量为32,故D正确.
故选D.
点评 本题考查了常见量的单位和数值,应注意的是一种物质的摩尔质量在数值上等于该物质的相对分子质量,摩尔质量的单位为g/mol.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
13.用电解法处理含硝(NO3-)废水的原理如图所示.下列说法错误的是( )
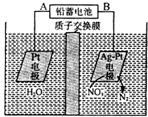

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2NO3-+12H++10e-═N2↑十6H2O | |
| D. | 若电路中流过2 mol电子,则阳极室溶液质量减少32g(忽略气体的溶解) |
14.已知:(1)某无机高分子混凝剂的化学式可表示为Al2(OH)nClm•yH2O; (2)AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平).则( )
| A. | 混凝剂具有强氧化性 | |
| B. | Al2(OH)nClm•yH2O化学式中m等于3-n | |
| C. | 若(2)中Cl2化学计量数为a,则AgF的化学计量数为3a | |
| D. | 若(2)中AgClO3、O2的化学计量数分别为b、c,则AgCl的化学计量数为5b+4c |
11.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 铁和稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ |
8.如表陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 铝比铁活泼 | 通常情况下,铝比铁更容易被腐蚀 |
| B | Fe3+具有氧化性 | 铁盐溶液能净水 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | Al2O3的熔点高于Al的熔点 | 铝箔被加热到熔化时,也不滴落下来 |
| A. | A | B. | B | C. | C | D. | D |
15.下列试剂不能用于区分SO2和CO2的是( )
| A. | 澄清石灰水 | B. | 酸性高锰酸钾溶液- | ||
| C. | 溴水 | D. | 硝酸钡溶液 |
13.下列有关“化学与生活”描述不正确的是( )
| A. | 核能的利用可能会造成放射性污染,应该立即关闭所有核电站 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 泡沫灭火器中使用了盐类水解的原理 | |
| D. | 宁德新能源公司生产的锂离子电池可以将化学能转化为电能 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.