题目内容
17.生产、生活中处处有化学,下列有关说法正确的是( )| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,pH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 药皂中含有的苯酚具有强氧化性,能杀菌消毒 | |
| D. | 胶体具有介稳性的主要原因是因胶体粒子所作的布朗运动使它们不容易聚集成质量较大的颗粒而沉降下来 |
分析 A.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉;
B.二氧化碳饱和溶液的PH不超过5.6,酸雨中的亚硫酸不稳定易被氧化生成硫酸;
C.苯酚无强氧化性;
D.胶体粒子带有电荷,粒子间相互排斥,具有介稳性.
解答 解:A.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉,因此工业上生产玻璃、水泥、漂白粉,均需要用石灰石为原料,故A正确;
B.酸雨中的亚硫酸不稳定易被氧化生成硫酸,亚硫酸是弱电解质、硫酸是强电解质,从而增强溶液的酸性,与二氧化碳无关,故B错误;
C.苯酚的水溶液可使菌体蛋白变性杀菌消毒,但苯酚无强氧化性,故C错误;
D.胶体具有介稳性的最主要原因是胶体粒子可以通过吸附而带有电荷,同种胶粒带同种电荷,而同种电荷会相互排斥,故D错误;
故选A.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的关系,题目难度不大.

练习册系列答案
相关题目
1.化学与生活生产密切相关,下列说法错误的是( )
| A. | 使用催化剂降低反应的活化能来提高化学反应效率 | |
| B. | 油脂和纤维素都属于高分子化合物 | |
| C. | 神州飞船的防护层中含聚四氯乙烯,合成它的单体属于卤代烃 | |
| D. | 中国古代利用明矾溶液的酸性清洗铜镜表面的铜锈 |
8.下列关于有机化合物的说法正确的是( )
| A. | 油脂的皂化反应可得到高级脂肪酸与甘油 | |
| B. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 | |
| C. | 可以淀粉为原料制取乙酸乙酯 | |
| D. | 油脂的皂化反应属于加成反应 |
5.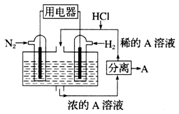 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
12.化学与社会都密切相关,下列说法正确的是( )
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| C. | 金属冶炼过程是金属离子得电子变成金属单质的氧化过程 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1molO2,转移电子数目为2NA | |
| C. | 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液Na+数目相等 | |
| D. | 常温常压下,4.6g乙醇中含有极性共价键的数目为0.8NA |
9.下列应用不涉及物质氧化性或还原性的是( )
| A. | 用葡萄糖制镜或保温瓶胆 | |
| B. | 用漂白液杀菌、消毒 | |
| C. | 用Na2SiO3溶液制备木材防火剂 | |
| D. | 用浸泡过高锰酸钾的硅藻土保鲜水果 |
13.下列关于浓HNO3和浓H2SO4的叙述中正确的是( )
| A. | 常温下都不能用铝制容器贮存 | |
| B. | 滴在紫色石蕊试纸上,试纸都变黑 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
8.某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)取1mol•L-1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是SO32-+H2O?HSO3-+OH-.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是2SO32-+O2=2SO42-.
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
实验ⅱ
①实验ⅱ证明,溶液中含有SO42-离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+,W溶液中c(Fe2+)一定很大,反应的离子方程式是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是4Fe2++O2+4H+=4Fe3++2H2O.
②实验过程和结果显示,O2、Fe3+、SO42-的氧化性强弱顺序是O2>Fe3+>SO42- O2>Fe3+>SO42-,.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+.
(1)取1mol•L-1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是SO32-+H2O?HSO3-+OH-.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是2SO32-+O2=2SO42-.
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
| 装置 | 操作 | 现象 |
 | 向2mL1mol•L-1FeCl3溶液中,逐滴滴加1mo•L-1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+,W溶液中c(Fe2+)一定很大,反应的离子方程式是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是4Fe2++O2+4H+=4Fe3++2H2O.
②实验过程和结果显示,O2、Fe3+、SO42-的氧化性强弱顺序是O2>Fe3+>SO42- O2>Fe3+>SO42-,.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+.