题目内容
关于离子浓度的关系,下列说法错误的是( )
| A、浓度均为0.1 mol/L的NH4Cl溶液和氨水等体积混合后:c(NH4+)+c(NH3?H2O)=2c(Cl- ) |
| B、新制氯水中:c(Cl- )>c(H+ )>c(OH- )>c(ClO- ) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(CH3COO-)>c(Na+)>c(H+ )>c(OH- ) |
| D、常温下,pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) |
考点:离子浓度大小的比较
专题:
分析:A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.新制氯水中次氯酸是弱电解质,在水溶液里电离程度较小,HCl和HClO都电离生成H+;
C.pH=5.6的CH3COOH与CH3COONa混合溶液,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,根据电荷守恒判断;
D.常温下,pH=2的盐酸浓度小于pH=12氨水浓度,等体积混合溶液时氨水有剩余,溶液呈碱性,根据电荷守恒判断c(NH4+ )、c(Cl- )相对大小.
B.新制氯水中次氯酸是弱电解质,在水溶液里电离程度较小,HCl和HClO都电离生成H+;
C.pH=5.6的CH3COOH与CH3COONa混合溶液,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,根据电荷守恒判断;
D.常温下,pH=2的盐酸浓度小于pH=12氨水浓度,等体积混合溶液时氨水有剩余,溶液呈碱性,根据电荷守恒判断c(NH4+ )、c(Cl- )相对大小.
解答:
解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(NH4+ )+c(NH3?H2O)═2c(Cl- ),故A正确;
B.新制氯水中次氯酸是弱电解质,在水溶液里电离程度较小,HCl和HClO都电离生成H+,所以c(Cl- )<c(H+ ),故B错误;
C.pH=5.6的CH3COOH与CH3COONa混合溶液,溶液呈酸性,即c(H+ )>c(OH- ),说明CH3COOH电离程度大于CH3COO-水解程度,根据电荷守恒得c(CH3COO-)>c(Na+),盐类水解较微弱,所以离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+ )>c(OH- ),故C正确;
D.常温下,pH=2的盐酸浓度小于pH=12氨水浓度,等体积混合溶液时氨水有剩余,溶液呈碱性,即c(OH- )>c(H+ ),根据电荷守恒得c(NH4+ )>c(Cl- ),溶液中一水合氨电离程度较小,所以溶液中离子浓度大小顺序是c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ),故D正确;
故选B.
B.新制氯水中次氯酸是弱电解质,在水溶液里电离程度较小,HCl和HClO都电离生成H+,所以c(Cl- )<c(H+ ),故B错误;
C.pH=5.6的CH3COOH与CH3COONa混合溶液,溶液呈酸性,即c(H+ )>c(OH- ),说明CH3COOH电离程度大于CH3COO-水解程度,根据电荷守恒得c(CH3COO-)>c(Na+),盐类水解较微弱,所以离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+ )>c(OH- ),故C正确;
D.常温下,pH=2的盐酸浓度小于pH=12氨水浓度,等体积混合溶液时氨水有剩余,溶液呈碱性,即c(OH- )>c(H+ ),根据电荷守恒得c(NH4+ )>c(Cl- ),溶液中一水合氨电离程度较小,所以溶液中离子浓度大小顺序是c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ),故D正确;
故选B.
点评:本题考查离子浓度大小比较,其解题方法为:先判断物质之间是否反应,然后根据物质的性质确定溶液酸碱性,最后结合守恒思想分析解答,题目难度不大.

练习册系列答案
相关题目
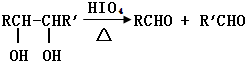
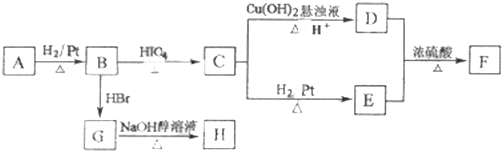
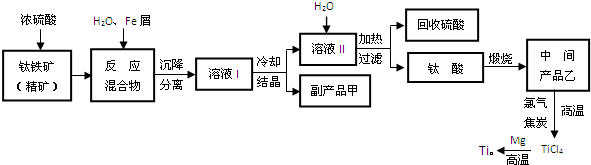
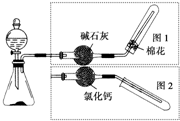 如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )
如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )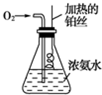 按如图所示的装置进行实验:
按如图所示的装置进行实验: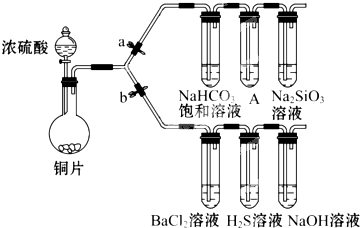 根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)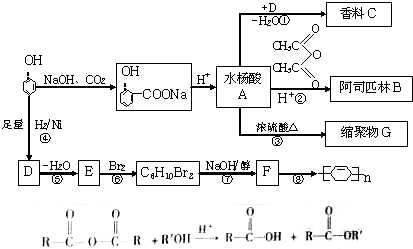
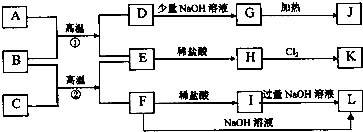
 已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)
已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)