题目内容
如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物资被略去,已知:A为水煤气的主要成分之一,B为红棕色粉末,C元素是地壳中含量最高的金属元素,反应①、②均为工业生产的重要反应.
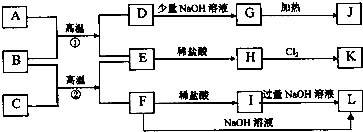
请回答下列问题:
(1)写出下列物质的化学式:D是 ,E ,F是 ,K是 .
(2)反应②的化学方程式为 .
(3)由G生成J的化学方程式为 .
(4)由I生成L的离子方程式为 .

请回答下列问题:
(1)写出下列物质的化学式:D是
(2)反应②的化学方程式为
(3)由G生成J的化学方程式为
(4)由I生成L的离子方程式为
考点:无机物的推断
专题:
分析:B为红棕色粉末,应为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe;顺推可知G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,C元素是地壳中含量最高的金属元素,所以C是Al,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,F应为Al2O3,则I为AlCl3,L为NaAlO2,结合物质的性质解答该题.
解答:
解:B为红棕色粉末,应为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe;顺推可知G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,C元素是地壳中含量最高的金属元素,所以C是Al,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,F应为Al2O3,则I为AlCl3,L为NaAlO2,
(1)由以上分析可知,D是CO2,E是Fe,F是Al2O3,K是FeCl3,故答案为:CO2,Fe,Al2O3,FeCl3;
(2)反应②铝和氧化铁发生的铝热反应,化学方程式为Fe2O3+2Al
A12O3+2Fe,故答案为:Fe2O3+2Al
A12O3+2Fe;
(3)G为NaHCO3,受热分解,化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;
(4)I为AlCl3,与过量的氢氧化钠会生成偏铝酸钠,离子方程式为Al3++4OH-═AlO2-+2H2O,故答案为:Al3++4OH-═AlO2-+2H2O;
(1)由以上分析可知,D是CO2,E是Fe,F是Al2O3,K是FeCl3,故答案为:CO2,Fe,Al2O3,FeCl3;
(2)反应②铝和氧化铁发生的铝热反应,化学方程式为Fe2O3+2Al
| ||
| ||
(3)G为NaHCO3,受热分解,化学方程式为2NaHCO3
| ||
| ||
(4)I为AlCl3,与过量的氢氧化钠会生成偏铝酸钠,离子方程式为Al3++4OH-═AlO2-+2H2O,故答案为:Al3++4OH-═AlO2-+2H2O;
点评:本题考查了物质转化关系的分析判断,物质性质的综合应用,主要考查工业两个重要反应的判断应用,铁及其化合物、铝及其化合物性质的应用,中等难度,解题时注意化学用语的规范表达.

练习册系列答案
相关题目
下列关于氧化物的叙述不正确的是( )
①非金属氧化物不一定属于酸性氧化物
②酸性氧化物都属于非金属氧化物
③金属氧化物都属于碱性氧化物
④碱性氧化物都属于金属氧化物
⑤酸性氧化物都能与水反应生成相应的含氧酸
⑥两性氧化物既能与酸也能与碱反应生成盐和水
⑦不能与酸反应的氧化物一定能与碱反应
⑧与水反应生成含氧酸的氧化物一定是酸性氧化物.
①非金属氧化物不一定属于酸性氧化物
②酸性氧化物都属于非金属氧化物
③金属氧化物都属于碱性氧化物
④碱性氧化物都属于金属氧化物
⑤酸性氧化物都能与水反应生成相应的含氧酸
⑥两性氧化物既能与酸也能与碱反应生成盐和水
⑦不能与酸反应的氧化物一定能与碱反应
⑧与水反应生成含氧酸的氧化物一定是酸性氧化物.
| A、①②③⑥⑧ |
| B、②③⑤⑦⑧ |
| C、②③⑤⑥⑦ |
| D、②③④⑥⑧ |
关于离子浓度的关系,下列说法错误的是( )
| A、浓度均为0.1 mol/L的NH4Cl溶液和氨水等体积混合后:c(NH4+)+c(NH3?H2O)=2c(Cl- ) |
| B、新制氯水中:c(Cl- )>c(H+ )>c(OH- )>c(ClO- ) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(CH3COO-)>c(Na+)>c(H+ )>c(OH- ) |
| D、常温下,pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) |
对下列实验的评价,正确的是( )
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、某无色溶液中滴入紫色石蕊试液显红色,该溶液一定是酸溶液 |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
 (苯胺,易被氧化)
(苯胺,易被氧化)