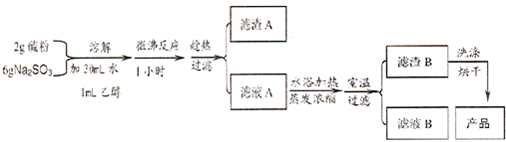
题目内容
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
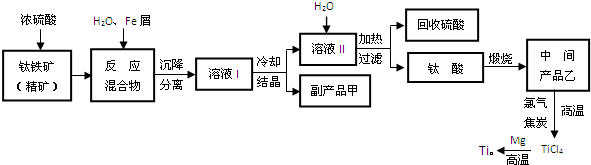
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲是 .
(2)上述生产流程中加入Fe屑的目的是 ,检验副产品甲是否变质的实验方法是 .
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去.
(4)最近,用熔融法直接电解中间产品乙制取金属钛获得成功.写出电解乙制取金属钛的化学方程式 .

回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲是
(2)上述生产流程中加入Fe屑的目的是
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入
(4)最近,用熔融法直接电解中间产品乙制取金属钛获得成功.写出电解乙制取金属钛的化学方程式
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)加入过量铁屑后溶液中含有Fe2+离子,则过滤后可得FeSO4?7H2O(或FeSO4);
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化;
(3)金属钛中混有少量杂质镁,可用盐酸除杂;
(4)电解熔融的二氧化钛可以得到金属钛.
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化;
(3)金属钛中混有少量杂质镁,可用盐酸除杂;
(4)电解熔融的二氧化钛可以得到金属钛.
解答:
解:(1)加入过量铁屑后溶液中含有Fe2+离子,则过滤后可得FeSO4?7H2O(或FeSO4),故答案为:FeSO4?7H2O;
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,亚铁离子易被氧化为铁离子,检验副产品甲是否变质,只要检验其中是否有铁离子即可,实验方法是:取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质,
故答案为:防止Fe2+氧化;取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质;
(3)金属钛中混有少量杂质镁,由题给信息钛的化学活性很小,仅能与氧气、氢氟酸等几种物质起反应可知,可用盐酸除杂,
故答案为:稀盐酸;
(4)煅烧钛酸可以得到二氧化钛,电解熔融的二氧化钛可以得到金属钛,即TiO2
Ti+O2↑,故答案为:TiO2
Ti+O2↑.
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,亚铁离子易被氧化为铁离子,检验副产品甲是否变质,只要检验其中是否有铁离子即可,实验方法是:取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质,
故答案为:防止Fe2+氧化;取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质;
(3)金属钛中混有少量杂质镁,由题给信息钛的化学活性很小,仅能与氧气、氢氟酸等几种物质起反应可知,可用盐酸除杂,
故答案为:稀盐酸;
(4)煅烧钛酸可以得到二氧化钛,电解熔融的二氧化钛可以得到金属钛,即TiO2
| ||
| ||
点评:本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
把20g氢氧化钠溶于水,配成500mL溶液,此溶液的物质的量浓度为( )
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、1.5mol?L-1 |
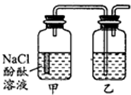 某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )| A、乙中导气管里形成一段水柱 |
| B、乙中导气管中产生气泡 |
| C、金属片剪口处溶液变红 |
| D、锌被腐蚀 |
关于离子浓度的关系,下列说法错误的是( )
| A、浓度均为0.1 mol/L的NH4Cl溶液和氨水等体积混合后:c(NH4+)+c(NH3?H2O)=2c(Cl- ) |
| B、新制氯水中:c(Cl- )>c(H+ )>c(OH- )>c(ClO- ) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(CH3COO-)>c(Na+)>c(H+ )>c(OH- ) |
| D、常温下,pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) |
如图实验装置、选用的试剂或实验操作中,都正确的是( )
A、实验室用装置A制取氨气. |
B、用B装置吸收氨气,并防止倒吸. |
C、用C装置稀释浓硫酸C. |
D、用D装置除去CO2中的HCl. |
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)